Oligonukleotyd Standard 6 Mix Analiza LC-UV
Jessie Zhixin Miao, Geoffrey Rule, Cory Muraco, Uma Sreenivasan
Merck
Oligonukleotyd

Chromatografia

Pomiar i analiza

Wprowadzenie
Wraz z pandemią COVID-19, oligonukleotydy (Oligos) udowodniły swoje znaczenie w zastosowaniach diagnostycznych i terapeutycznych. Obecnie 11 leków oligonukleotydowych obejmujących wiele obszarów chorobowych zostało zatwierdzonych przez FDA.1, 2 Przeszkody uniemożliwiające szybszy rozwój terapii oligonukleotydowych obejmują wyzwania związane z niekorzystnymi badaniami wchłaniania, dystrybucji, metabolizmu, wydalania i toksyczności (ADMET) w wielu badaniach klinicznych.2 Opracowano pewne strategie, aby sprostać tym wyzwaniom, takie jak modyfikacja chemiczna w celu poprawy dostarczania leków.
Syntetyczne oligonukleotydy to zazwyczaj małe, jedno- lub dwuniciowe zmodyfikowane kwasy nukleinowe.2 Istnieje wiele uznanych technik analizy i charakterystyki oligonukleotydów, w tym elektroforeza w żelu kapilarnym (CGE), chromatografia jonowymienna (IEX) i chromatografia cieczowa w odwróconej fazie z parą jonową (IP-RPLC). Ogólnie rzecz biorąc, chromatografia cieczowa jest bardzo trudna ze względu na podobieństwo struktur oligonukleotydów, bardzo polarne właściwości, obecność skróconych i/lub zmodyfikowanych oligonukleotydów, łatwość samoasocjacji w różnych konformacjach i powinowactwo do powierzchni metalowych.1,2 Niniejsza aplikacja opisuje separację wewnętrznie produkowanej mieszanki oligonukleotydów standardowych (Oligo Standard 6), która zawiera sześć oligonukleotydów, na kolumnie Chromolith® RP-18e z portfolio Supelco®.
Procedura eksperymentalna
Oligo Standard 6 jest wewnętrzną (wewnętrzną) mieszanką przydatności systemu do oceny HPLC-UV separacji oligonukleotydów. Zawiera sześć składników o masach cząsteczkowych 3588,3 Da (Oligo 1), 4157,93 Da (Oligo 2), 7580,83 Da (Oligo 3), 10014,35 Da (Oligo 4), 6116,97 Da (Oligo 5) i 4395,8 Da (Oligo 6), zgodnie z ich kolejnością elucji na testowanych kolumnach Chromolith® RP-18e.
Przygotowanie odczynnika
50 mM octanu trietyloamoniowego (TEAA)
Aby przygotować 1 L 50 mM TEAA, 50 mL TEAA (handlowy roztwór 1 M) dodano do 950 mL wody klasy HPLC i dobrze wymieszano.
20 mM octanu trietyloamoniowego (TEAA)
Aby przygotować 1 L 20 mM TEAA, 20 mL TEAA (komercyjny 1 M roztwór) dodano do 980 mL wody klasy HPLC i dobrze wymieszano.
5 mM octanu trietyloamoniowego (TEAA)
Aby przygotować 1 L 5 mM TEAA, 5 mL TEAA (komercyjny 1 M roztwór) dodano do 995 mL wody klasy HPLC i dobrze wymieszano.
Przygotowanie próbki
5 µM próbki Oligo Standard 6
1 ml wody o czystości HPLC dodano do fiolki z próbką zawierającą 5 nmoli każdego z sześciu składników oligo i dobrze wymieszano.
Ustawienia systemu HPLC-UV i analiza danych
Essential settings of the HPLC-UV chromatography system for analysis of Oligo Standard 6 are listed in Table 1 below.
Wyniki i dyskusja
Dzięki wiązaniu grup fosforanowych, oligonukleotydy mają tendencję do przyklejania się do powierzchni metalowych obecnych w sprzęcie kolumnowym ze stali nierdzewnej i systemie LC, co skutkuje zmniejszoną czułością i niedokładnym oznaczeniem ilościowym. Naukowcy podjęli szereg wysiłków w celu złagodzenia tej adsorpcji wewnątrz oprzyrządowania, takich jak traktowanie systemu EDTA, fazą ruchomą o wysokim pH lub wykorzystanie obojętnych biologicznie komponentów systemu HPLC.3 Konwencjonalne kolumny HPLC są zwykle pakowane w kolumny metalowe, narażając powierzchnie metalowe na ładunek dodatni, który może adsorbować kwaśne cząsteczki, takie jak oligonukleotydy zawierające grupy fosforanowe. Kolumny HPLC Chromolith® są wykonane z wysoce porowatych monolitycznych prętów krzemionkowych. Kolumny te mają innowacyjną, bimodalną strukturę porów i są pakowane w kolumny PEEK (polieteroeteroketon) niezawierające metali. Ta cecha sprawia, że są one dobrym kandydatem do analizy oligonukleotydów.
Chromolith® Performance RP-18e, kolumna 100 x 4,6 mm
Test wysokiego natężenia przepływu
Aby poprawić wydajność separacji, wielkość cząstek materiału wypełniającego jest zwykle zmniejszana. Obecnie konwencjonalne kolumny HPLC zawierają cząstki krzemionki o wielkości 5, 3, 2, a nawet poniżej 2 µm. Jednak mniejszy rozmiar cząstek spowoduje wyższe przeciwciśnienie wpływające na przepustowość testu, wytrzymałość i żywotność kolumny. Optymalnym rozwiązaniem jest zastosowanie kolumny, która oferuje szybszą przepustowość bez ryzyka wysokiego przeciwciśnienia. Ponieważ kolumna Chromolith® nie jest wypełniona cząsteczkami krzemionki, ale pojedynczym prętem polimerowego żelu krzemionkowego o wysokiej czystości, unikalna konstrukcja umożliwia wysoce wydajną separację przy przyspieszonych prędkościach, co jest idealne do analiz o wysokiej przepustowości.4
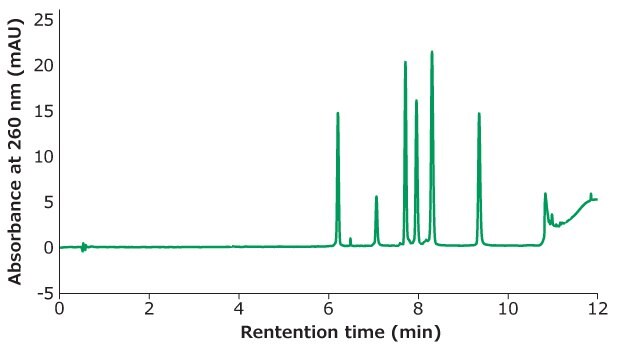
Rysunek 1.Separacja Oligo Standard 6 na kolumnie Chromolith®Performance RP-18e, 100 x 4,6 mm przy szybkości przepływu 3 ml/min z gradientem od 5% B do 15% B w ciągu 10 minut. Faza ruchoma A: 50 mM TEAA w wodzie; faza ruchoma B: acetonitryl. Objętość iniekcji: 5 μL (25 pmol na kolumnie).
Rysunek 1 pokazuje rozdział oligonukleotydu Oligo Standard 6 na kolumnie Chromolith® RP-18e przy natężeniu przepływu 3 ml/min i wstrzyknięciu tylko 25 pmol na kolumnę dla każdego oligonukleotydu. Jako fazę ruchomą A zastosowano 50 mM TEAA, a jako fazę ruchomą B acetonitryl z gradientem 5% B rosnącym do 15% B w ciągu 10 minut. Typowe przeciwciśnienie przy 3 ml/min wynosi 50 barów, co jest korzystne dla testów o wysokiej przepustowości.
Test stężenia dodatku jonowo-parowego
W analizie jakościowej i ilościowej zanieczyszczeń oligonukleotydowych dominującą techniką jest chromatografia cieczowa w odwróconej fazie z parą jonową. Odczynniki parujące jony dodawane do fazy ruchomej to zazwyczaj kilka soli alkiloamoniowych, które są adsorbowane na sorbencie kolumny z ładunkami dodatnimi wystawionymi na oddziaływanie z ujemnie naładowanymi oligonukleotydami. Octan trietyloamonu (TEAA) jest jednym z powszechnie stosowanych odczynników do parowania jonów w analizie LC-UV oligonukleotydów. Optymalizacja stężenia dodatku do parowania jonowego jest ważna dla osiągnięcia wydajnej separacji przy jednoczesnej minimalizacji kosztów zużycia dodatku. W niniejszej pracy przeprowadzono optymalizację stężenia TEAA.
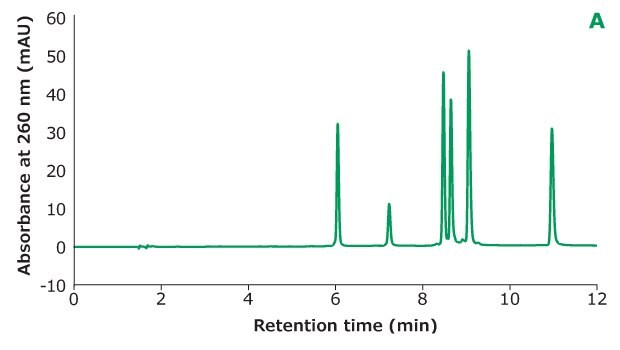
Rysunek 2A.Separacja Oligo Standardu 6 na kolumnie Chromolith® Performance RP-18e, 100 x 4,6 mm z różnym stężeniem TEAA w fazie ruchomej A: 50 mM TEAA. Rozdzielczość jest obliczana między każdymi dwoma sąsiednimi pikami.
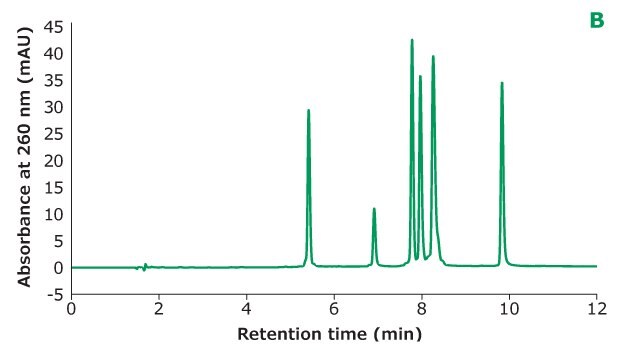
Rysunek 2B.Separacja Oligo Standardu 6 na kolumnie Chromolith® Performance RP-18e, 100 x 4,6 mm z różnym stężeniem TEAA w fazie ruchomej A: 20 mM TEAA. Rozdzielczość jest obliczana między każdymi dwoma sąsiednimi pikami.
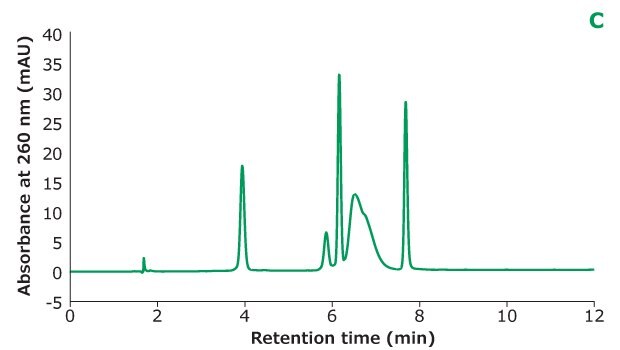
Rysunek 2C.Separacja Oligo Standardu 6 na kolumnie Chromolith® Performance RP-18e, 100 x 4,6 mm z różnym stężeniem TEAA w fazie ruchomej A: 5 mM TEAA. Rozdzielczość jest obliczana między każdymi dwoma sąsiednimi pikami.
Rysunek 2 pokazuje różne stężenia TEAA testowane w fazie ruchomej A z acetonitrylem jako fazą ruchomą B w separacji. Pięć mikrolitrów próbki Oligo Standard 6 wstrzyknięto na kolumnę Chromolith® Performance RP-18e, 100 x 4,6 mm przy szybkości przepływu 1 ml/min z gradientem od 8% B do 15% B w ciągu 10 minut dla każdego testu. Przy 50 mM TEAA w fazie ruchomej A, oligonukleotydy były dobrze rozdzielone z czasem retencji dla Oligo 1 do 6 wynoszącym 6,051 min, 7,232 min, 8,476 min, 8,647 min, 9,058 min i 10,964 min. Gdy stężenie TEAA zostało obniżone do 20 mM, Oligo 1 do 6 eluowały w tej samej kolejności, ale z mniejszą retencją na kolumnie. Z wyjątkiem Oligos 1 i 2, rozdzielczość między każdą parą pików jest również niższa. Gdy stężenie TEAA zostało dodatkowo obniżone do 5 mM, oligonukleotydy 4 i 5 nie zostały rozdzielone, co wskazuje, że siła parowania jonów nie jest wystarczająco wysoka, aby rozdzielić te dwa oligonukleotydy. Porównując wysokości piku sześciu oligonukleotydów w trzech różnych stężeniach TEAA, 50 mM TEAA dało najwyższą wysokość piku, jak pokazano w tabeli na Rysunku 2. Dlatego stężenie dodatku do parowania jonowego musi być zoptymalizowane w oparciu o charakterystykę oligonukleotydów.
Kolumna Chromolith® HighResolution RP-18e, 2 mm I.D.
Kolumna Chromolith® HighResolution (HR) posiada makropory o wielkości 1,15 µm w porównaniu z 2 µm w standardowej kolumnie Chromolith® . Modyfikacja ta skutkuje wyższą wydajnością separacji i lepszym kształtem piku. Chociaż powoduje to wyższe ciśnienie wsteczne, jest ono nadal o połowę mniejsze niż w przypadku jakiejkolwiek kolumny cząsteczkowej o podobnej wydajności.4
W tym przypadku 3 µL próbki Oligo Standard 6 wstrzyknięto na kolumnę Chromolith® HighResolution RP-18e, 100 x 2.0 mm z prędkością 0,4 ml/min z gradientem od 8% B do 15% B w ciągu 10 minut. Rysunek 3 jest nałożeniem trzech zastrzyków pokazujących spójną retencję i odpowiedź. Stężenie 50 mM TEAA zastosowano jako fazę ruchomą A, a acetonitryl jako fazę ruchomą B. Rozdzielczość między Oligo 4 i 5 wynosi 4,936.
.

Rysunek 3.Separacja Oligo Standard 6 na kolumnie Chromolith® HighResolution RP-18e, 100 x 2,0 mm. Faza ruchoma A: 50 mM TEAA w wodzie, faza ruchoma B: acetonitryl; gradient: 8% B do 15% B w ciągu 10 minut przy szybkości przepływu 0,4 ml/min, temp. kolumny: 40 oC, Wstrzyknięcie: 3μl (15 pmol na kolumnie).
Krótsza kolumna Chromolith® HighResolution RP-18e, 50 x 2 mm została porównana z tymi samymi warunkami przy objętości wtrysku 5 µL użytej na Rysunku 3. Jak pokazano na Rysunku 4, na kolumnie 50 x 2 mm wszystkie sześć oligonukleotydów zostało wymytych w ciągu 10 minut z rozdzielczością między Oligo 4 i 5 wynoszącą 3,921. Tak więc kolumna Chromolith® HR RP-18e jest zdolna do analizy oligonukleotydów przy użyciu przepływów zgodnych z LC-MS.

Rysunek 4.Separacja Oligo Standard 6 na kolumnie Chromolith® High Resolution RP-18e, 50 x 2,0 mm. Faza ruchoma A: 50 mM TEAA w wodzie, faza ruchoma B: acetonitryl; gradient: 8% B do 15% B w ciągu 10 minut przy szybkości przepływu 0,4 ml/min, temp. kolumny: 40 oC, Wstrzyknięcie: 5 μL (25 pmol na kolumnie).
Wnioski
W niniejszej nocie aplikacyjnej zademonstrowano rozdzielanie Oligo Standard 6, wewnętrznie stworzonej mieszanki przydatności systemu HPLC-UV, na standardowych kolumnach Chromolith® i Chromolith® High-Resolution RP-18e. Przepływy do 3 ml/min zostały ocenione na standardowej kolumnie Chromolith® z doskonałą separacją sześciu oligosów, co wskazuje, że jest ona idealna do testów o wysokiej przepustowości. Omówiono wpływ odczynnika do parowania jonów, TEAA, na separację Oligo Standard 6, aby zapewnić wskazówki optymalizacyjne w analizie oligo. Kolumny Chromolith® High-Resolution RP-18e zostały ocenione przy typowym natężeniu przepływu LC-MS, wykazując, że kolumna ta jest odpowiednia do analizy oligonukleotydów metodą spektrometrii mas. Ponadto polimerowa obudowa kolumny może być używana jako część bezmetalowego lub obojętnego biologicznie systemu HPLC.
Podziękowania
Autorzy chcieliby podziękować Pierre Potier za dostarczenie mieszanki oligonukleotydów Standard Six i wsparcie techniczne.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?