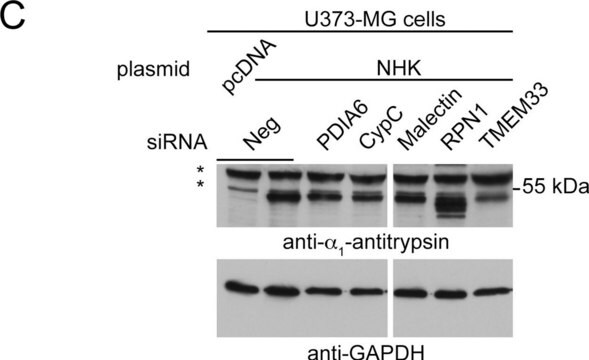
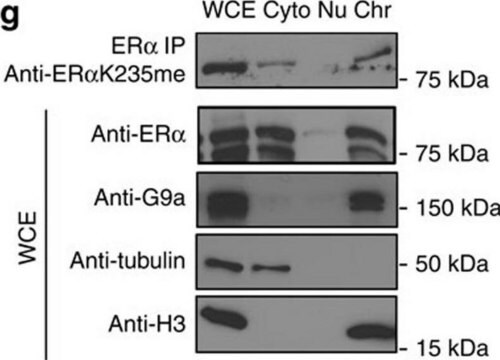
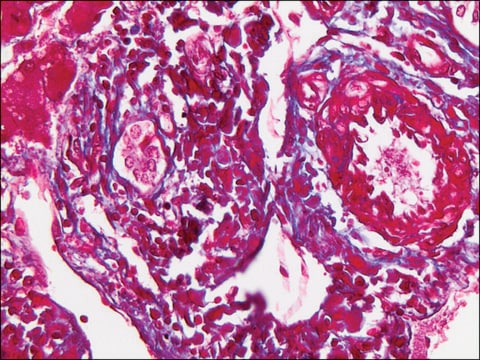
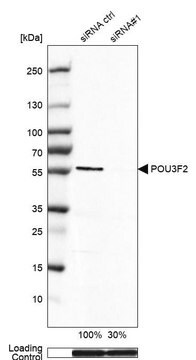
SAB4700771
Monoclonal Anti-HIV protease antibody produced in mouse
clone 1696, purified immunoglobulin, buffered aqueous solution
About This Item
Polecane produkty
pochodzenie biologiczne
mouse
białko sprzężone
unconjugated
forma przeciwciała
purified immunoglobulin
rodzaj przeciwciała
primary antibodies
klon
1696, monoclonal
Formularz
buffered aqueous solution
reaktywność gatunkowa
human immunodeficiency virus
stężenie
1 mg/mL
metody
FUNC: suitable
immunoblotting: suitable
indirect ELISA: suitable
izotyp
IgG1
Warunki transportu
wet ice
temp. przechowywania
2-8°C
docelowa modyfikacja potranslacyjna
unmodified
Opis ogólny
Immunogen
Działania biochem./fizjol.
Cechy i korzyści
Postać fizyczna
Oświadczenie o zrzeczeniu się odpowiedzialności
Nie możesz znaleźć właściwego produktu?
Wypróbuj nasz Narzędzie selektora produktów.
Kod klasy składowania
10 - Combustible liquids
Temperatura zapłonu (°F)
Not applicable
Temperatura zapłonu (°C)
Not applicable
Wybierz jedną z najnowszych wersji:
Certyfikaty analizy (CoA)
Nie widzisz odpowiedniej wersji?
Jeśli potrzebujesz konkretnej wersji, możesz wyszukać konkretny certyfikat według numeru partii lub serii.
Masz już ten produkt?
Dokumenty związane z niedawno zakupionymi produktami zostały zamieszczone w Bibliotece dokumentów.
Nasz zespół naukowców ma doświadczenie we wszystkich obszarach badań, w tym w naukach przyrodniczych, materiałoznawstwie, syntezie chemicznej, chromatografii, analityce i wielu innych dziedzinach.
Skontaktuj się z zespołem ds. pomocy technicznej