616371
Aprotinin, Bovine, Recombinant, Nicotiana sp., Animal-Free
recombinant, expressed in Nicotiana, heat and acid-stable competitive, reversible inhibitor of serine proteases
Synonim(y):
Aprotinin, Bovine, Recombinant, Nicotiana sp., Animal-Free, Pancreatic Trypsin Inhibitor, Trypsin-Kallikrein Inhibitor, Kallikrein-Trypsin Inactivator, Antikrein, Basic Pancreatic Trypsin Inhibitor
About This Item
Polecane produkty
rekombinowane
expressed in Nicotiana
Poziom jakości
opis
Merck USA index - 14, 757
Próba
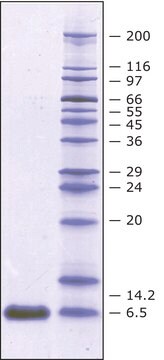
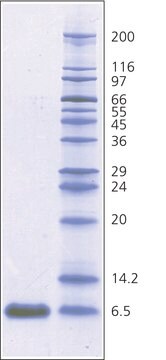
≥98% (SDS-PAGE)
Formularz
powder
aktywność właściwa
≥5.0 units/mg protein
producent / nazwa handlowa
Calbiochem®
warunki przechowywania
OK to freeze
kolor
white to off-white
Warunki transportu
wet ice
temp. przechowywania
2-8°C
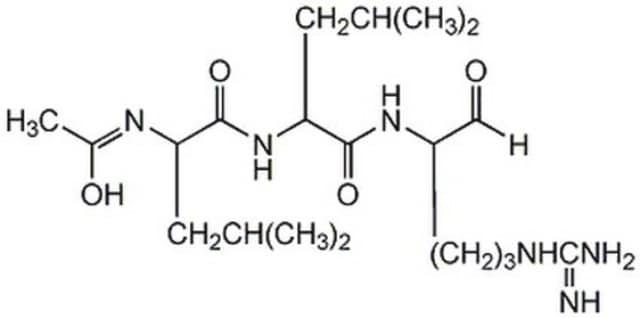
ciąg SMILES
S1SCC2NC(=O)CNC(=O)CNC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C5NC(=O)C(NC(=O)CNC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C(NC(=O)C9N(CCC9)C(=O)CNC(=O)C(NC(=O)C(NC(=O)C%11N(CCC%11)C(=O
Klucz InChI
ZPNFWUPYTFPOJU-UHFFFAOYSA-N
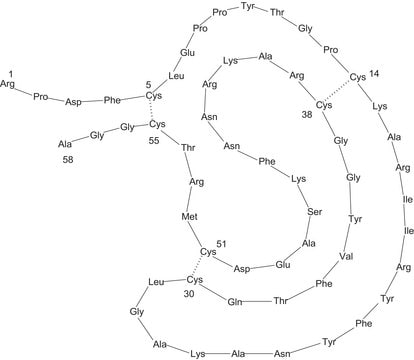
Opis ogólny
Działania biochem./fizjol.
chymotrypsin
Opakowanie
Ostrzeżenie
Definicja jednostki
Postać fizyczna
Inne uwagi
Informacje prawne
Kod klasy składowania
12 - Non Combustible Liquids
Klasa zagrożenia wodnego (WGK)
nwg
Temperatura zapłonu (°F)
Not applicable
Temperatura zapłonu (°C)
Not applicable
Certyfikaty analizy (CoA)
Poszukaj Certyfikaty analizy (CoA), wpisując numer partii/serii produktów. Numery serii i partii można znaleźć na etykiecie produktu po słowach „seria” lub „partia”.
Masz już ten produkt?
Dokumenty związane z niedawno zakupionymi produktami zostały zamieszczone w Bibliotece dokumentów.
Klienci oglądali również te produkty
Nasz zespół naukowców ma doświadczenie we wszystkich obszarach badań, w tym w naukach przyrodniczych, materiałoznawstwie, syntezie chemicznej, chromatografii, analityce i wielu innych dziedzinach.
Skontaktuj się z zespołem ds. pomocy technicznej