429700
Leptyna, ludzka, rekombinowana, E. coli
Synonim(y):
rhOB
Zaloguj sięWyświetlanie cen organizacyjnych i kontraktowych
About This Item
Polecane produkty
pochodzenie biologiczne
Escherichia coli
Poziom jakości
opis
Merck USA index - 14, 5443
sterylność
non-sterile
Próba
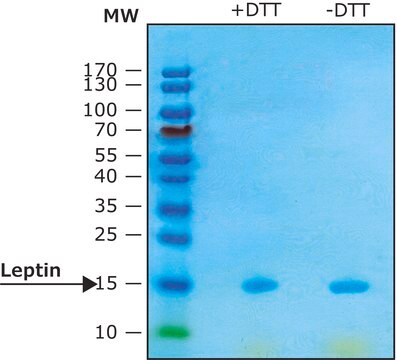
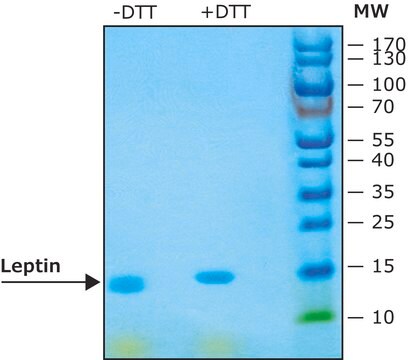
≥97% (SDS-PAGE)
Formularz
lyophilized
producent / nazwa handlowa
Calbiochem®
warunki przechowywania
OK to freeze
zanieczyszczenia
≤1.0 EU/μg Endotoxin (EU/μg leptin)
Warunki transportu
ambient
temp. przechowywania
−70°C
Opis ogólny
Rekombinowana ludzka leptyna wyrażana w E. coli. Leptyna została pierwotnie zidentyfikowana jako produkt białkowy mysiego genu otyłości. U myszy z mutacjami w genie obese, które blokują syntezę leptyny, stwierdzono otyłość i cukrzycę oraz obniżoną aktywność, metabolizm i temperaturę ciała. Klony cDNA kodujące leptynę zostały wyizolowane z komórek ludzkich, małpich, mysich i szczurzych. Ludzka leptyna wykazuje około 84% identyczności sekwencji z białkiem mysim. Ludzki cDNA leptyny koduje białko o długości 167 aminokwasów z 21 aminokwasową sekwencją sygnałową, która jest rozszczepiana w celu uzyskania dojrzałego białka o długości 146 aminokwasów. Wykazano, że ekspresja mRNA leptyny jest ograniczona do tkanki tłuszczowej.
Następnie sklonowano receptor o wysokim powinowactwie dla leptyny (OB-R) z homologią do gp130 i receptora G-CSF. Domena cytoplazmatyczna OB-R przekazuje sygnał leptyny poprzez szlak JAK-STAT. Chociaż początkowo wykazano, że mRNA OB-R ulega ekspresji głównie w splocie naczyniówkowym i podwzgórzu, nowsze dane ujawniły również ekspresję tego receptora w komórkach śródbłonka (Ecs). Co więcej, aktywność angiogenną leptyny wykazano zarówno in vitro, jak i in vivo, co sugeruje fizyczny mechanizm, w którym indukowana leptyną angiogeneza może ułatwiać zwiększone wydatkowanie energii.
Następnie sklonowano receptor o wysokim powinowactwie dla leptyny (OB-R) z homologią do gp130 i receptora G-CSF. Domena cytoplazmatyczna OB-R przekazuje sygnał leptyny poprzez szlak JAK-STAT. Chociaż początkowo wykazano, że mRNA OB-R ulega ekspresji głównie w splocie naczyniówkowym i podwzgórzu, nowsze dane ujawniły również ekspresję tego receptora w komórkach śródbłonka (Ecs). Co więcej, aktywność angiogenną leptyny wykazano zarówno in vitro, jak i in vivo, co sugeruje fizyczny mechanizm, w którym indukowana leptyną angiogeneza może ułatwiać zwiększone wydatkowanie energii.
Działania biochem./fizjol.
ED₅₀ = 0,4-2 ng/ml, mierzone jego zdolnością do indukowania proliferacji zależnych od leptyny mysich komórek BAF3 transfekowanych rOB-R.
Ostrzeżenie
Toksyczność: Standardowa obsługa (A)
Postać fizyczna
Liofilizowany ze sterylnego przefiltrowanego roztworu w PBS.
Rekonstytucja
Aby odtworzyć liofilizowaną leptynę, dodaj do fiolki 15 mM sterylnego HCl (0,5 ml/1 mg fiolkę lub 2,5 ml/5 mg fiolkę). Po całkowitym rozpuszczeniu białka dodaj 7,5 mM sterylnego NaOH (0,3 ml/1 mg fiolki lub 1,5 ml/5 mg fiolki), aby doprowadzić pH do ~5,2. Liofilizowane próbki są stabilne przez co najmniej sześć miesięcy w temperaturze -70°C. Po rekonstytucji cytokina ta może być przechowywana w sterylnych warunkach w temperaturze 4°C przez jeden miesiąc lub w temperaturze -70°C przez trzy miesiące bez wykrywalnej utraty aktywności. Należy unikać powtarzających się cykli zamrażania/rozmrażania odtworzonych roztworów.
Inne uwagi
Anderwald, C., et al. 2002. Mol. Endocrinol.16, 1612.
Ookuma, M., et al. 1998. Diabetes 47, 219.
Campfield, L.A., et al. 1995. Science 269, 546.
Halaas, J.L., et al. 1995. Science 269, 543.
Pelleymounter, M.A., et al. 1995. Science 269, 540.
Zhang, Y., et al. 1994. Nature372, 425.
Ookuma, M., et al. 1998. Diabetes 47, 219.
Campfield, L.A., et al. 1995. Science 269, 546.
Halaas, J.L., et al. 1995. Science 269, 543.
Pelleymounter, M.A., et al. 1995. Science 269, 540.
Zhang, Y., et al. 1994. Nature372, 425.
Informacje prawne
CALBIOCHEM is a registered trademark of Merck KGaA, Darmstadt, Germany
Ta strona może zawierać tekst przetłumaczony maszynowo.
Kod klasy składowania
11 - Combustible Solids
Klasa zagrożenia wodnego (WGK)
WGK 1
Certyfikaty analizy (CoA)
Poszukaj Certyfikaty analizy (CoA), wpisując numer partii/serii produktów. Numery serii i partii można znaleźć na etykiecie produktu po słowach „seria” lub „partia”.
Masz już ten produkt?
Dokumenty związane z niedawno zakupionymi produktami zostały zamieszczone w Bibliotece dokumentów.
Nasz zespół naukowców ma doświadczenie we wszystkich obszarach badań, w tym w naukach przyrodniczych, materiałoznawstwie, syntezie chemicznej, chromatografii, analityce i wielu innych dziedzinach.
Skontaktuj się z zespołem ds. pomocy technicznej