自己組織化単分子層とSAMDI-ToF質量分析法による表面化学
Prof. Milan Mrksich
Department of Chemistry, The University of Chicago Chicago, IL
Material Matters 2008, Vol.3 No.3
現代の合成化学は、複雑な分子構造の合成を可能にし、医薬品、触媒、機能性高分子の開発には欠かせないものとなりました。化学者はもはや、目的の構造が合成できるかどうかではなく、いかに効率的に合成できるかを求めています。しかし同様の反応を表面合成に用いる場合にはかなり異なる手法が求められます。明確な構造とさまざまな官能基を有する表面を簡単に作成することができますが、界面反応の生成物の評価が難しいため、最も単純な置換を実行することさえ困難です。皮肉なことに、界面反応では後処理に反応混合物で表面を洗浄するだけなので、均一相での反応よりもはるかに簡単に実施できます。しかし、生成物、収率、反応速度の評価にかなりの困難が伴います。溶液中で行う反応の場合、生成物は容易に単離・精製でき、NMR、IRや、他の分光法で確認できますが、同様の反応を2次元の界面で実行すると生成量が少ないために、上記の分析方法を用いることができません。その代わりに、得られる構造情報に制限がありますが感度の高い種々の方法を利用する必要があります1。
本稿では、界面反応によって得られる生成物を迅速に評価できる自己組織化単分子層(self-assembled monolayers)とマトリックス支援レーザー脱離イオン化質量分析法(matrix-assisted laser desorption-ionization mass spectrometry)とを組み合わせた「SAMDI MS」と呼ばれる手法について説明します2。自己組織化単分子層は、末端が置換されたアルカンチオールの溶液中に金で被覆した基板を通常の実験室の環境で浸漬することによって容易に作成でき、合成的に柔軟であることから、表面化学にとって魅力的な方法です。この柔軟性の理由としては、さまざまな末端官能基をもつアルカンチオールを用いる成膜プロセスに使用できること、チオールの金への化学吸着がきわめて特異的であること、単分子層が熱的に安定でありさまざまな溶媒や反応物と使用できることが挙げられます3。アルカンチオールがメーカーから購入しやすくなり、大がかりな器具や設備を必要としないため、この方法は合成化学者にとって身近なものとなりつつあります。SAMDI MS技術の発展によって、最終的には自己組織化単分子層上での分子反応を評価する迅速かつ一般的な方法が確立され、分子表面化学の基礎・応用研究の大きな発展が促されることになると期待されています。
レーザー脱離質量分析法を使って自己組織化単分子層を評価した最初の例はHemminger、FritschとWilkins、Hanleyの研究室によるものでした4-6。FritschとWilkinsは、たとえば、308 nmのレーザーを使って単分子層を脱着させ、アルカンチオラートの酸化で生じるアルカンスルホナートを観察することに成功しました。当時は、市販のレーザー脱離質量分析装置が少なく、単分子層上の界面反応の例も少なかったため、この方法はあまり普及しませんでした。数年後、われわれは、界面反応を評価する難しさに直面した際に、幅広い種類の官能基を導入した自己組織化単分子層に対して市販のマトリックス支援レーザー脱離イオン化質量分析装置を適用できることを見出しました7。通常の実験では、SAMDI MSに用いる一般的なマトリックス分子の溶液を単分子層に塗布して乾燥させます。単分子層に窒素レーザーを照射すると、アルカンチオール(または類似のジスルフィド)が金基板から効率的に遊離して、この分子の質量が分かります(図1)。最初の例では、この方法を利用して、単分子層に結合したマレイミド基へのペンタメチルシクロペンタジエンの付加環化、アミドの形成、tert-ブチルエステルの脱保護を評価しました。いずれの場合も、SAMDIスペクトルは、反応前と反応後の置換されたアルカンチオールまたはそのジスルフィドに帰属されるピークを示しました。SAMDIは、アルカンチオール中に存在する官能基の特性ではなく、アルカンチオールの全質量に関する情報を提供するという点において、他の分光法では得られない情報が得られます。またSAMDIは、サンプルの分析にかかる時間が10分未満と、スペクトルを迅速に入手できるため、反応収率の評価や予想される生成物の存在の確認に有用です。
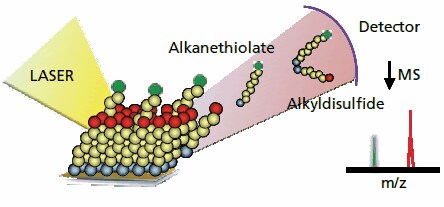
図1SAMDI MSと呼ばれる手法でマトリックス支援レーザー脱離イオン化質量分析を利用すると自己組織化単分子層を評価することができます。窒素レーザーを利用して単分子層を脱離させるとアルカンチオラートとそのジスルフィド分子が生じます。質量分析計からは、この分子の質量電荷比が得られ、生成物、収率、界面反応の速度に関する情報が入手できます。
この初期の報告以来、SAMDIは、単分子層の電気化学反応の生成物の評価8、コンビナトリアル法による反応の探索9、酵素を介する多数の変換反応の例10-13をはじめとするさまざまな用途に利用されています。以下に説明する3つの例で、自己組織化単分子層上の界面反応の生成物を評価し、官能基を導入した表面を用いた様々な研究を可能にするSAMDIのユニークな特徴をご紹介します。
最初の例では、末端にアルキン基を有する単分子層の反応を扱います。塩基促進による末端の水素原子を重水素原子に交換する反応は単純ですが、単分子層で行う場合は評価が極めて困難です。末端がアルキン基の単分子層と末端がメチル基の単分子層との混合物から成る単分子層のSAMDIスペクトルは、混合した対称的なジスルフィドに対応するピークを示しました。この単分子層を水酸化ナトリウムで処理したのち重水で処理すると、末端の水素原子を交換することができました。これは、ジスルフィドの質量がそれぞれ1ダルトンと2ダルトン増加したことにより確認できます(図2)。この例から、質量分析法を界面反応の評価に簡単に応用できることと、この方法が優れた質量分解能を持つことが分かります。また、この方法を用いて、アルキンを水和するとメチルケトンが生じ、薗頭カップリングを行うとフェニルアセチレンが生じることも実証できました。
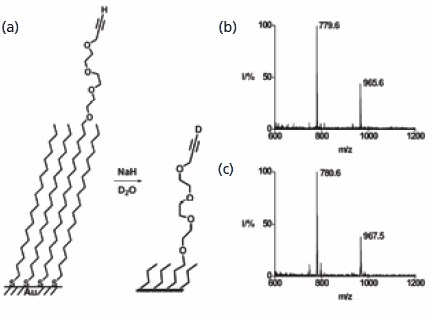
図2SAMDI MSを使って、末端アルキンの水素が重水素に交換されたかを確認しました。反応前のマススペクトルはm/z 779.6でピークを示し、反応後は780.6にシフトしています。ジスルフィドのピークでは、予想されたとおり、質量が2ダルトン増加していることが分かります。
2番目の例は、自己組織化単分子層の構造を構築するための多段階合成反応の開発です。単分子層は「バイオチップ」用途によく用いられます。ペプチド、炭水化物または低分子が並ぶバイオチップの表面は、酵素の基質やタンパク質のリガンドを特定するために利用されます14。この用途では、多くの場合、単分子層に結合させる分子を既存の方法で最初に合成したのちに、適切な結合反応を使ってこれを単分子層に固定化します。オリゴ糖など特定の分子の場合は、調製に必要な時間と費用のために、作製できるアレイのサイズが限定されます。
ペプチドアレイやオリゴヌクレオチドアレイに関する初期の研究では、基板上に直接分子を合成することによって、数百から数千もの一連の生体分子を迅速かつ効率的に表面に作製する方法が利用されました15。この例では、アレイ合成に用いる一連の界面反応の開発と最適化を行うのにかなりの取り組みがなされ、なかでも最も大きな課題はその界面反応の生成物と収率を評価することでした。最近われわれはSAMDIを利用し、単分子層で直接多段階合成を行ってオリゴ糖アレイを調製する方法を開発しました16。
オリゴ糖アレイの合成に用いた方法を図3に示します。これは末端にトリ(エチレングリコール)を持つアルカンチオラートのバックグラウンドに対して5%の密度でフェノール基が存在する単分子層から出発します。前者は炭水化物ビルディングブロックを結合するための求核剤になります。後者は非特異的なタンパク質の吸着を効果的に防ぐため、そしてその後の固定化したオリゴ糖の生化学的アッセイに重要です17。その後の工程で選択的に脱保護できるように4番目の水酸基がレブリン酸エステルとして保護されているトリアセチル化された単糖類をトリクロロアセトイミド酸エステルに変換したのちに、トリフルオロメタンスルホン酸トリメチルシリルで活性化してフェノール基とカップリングさせました。この単分子層をヒドラジンで処理してレブリン酸エステル基を除去したのちに、もうひとつの単糖類で処理することで完全に保護された二糖類を得ました。ナトリウムメトキシドで処理するとアセチル基が除去され、固定化された二糖類が得られました。SAMDIスペクトルから、各段階が高収率で進行して予想された生成物が得られていることがわかりました(図3)。この一連の処理を24種類の異なる二糖類アレイの調製に適用しました。この作成は6時間未満で完了し、その後グリコシルトランスフェラーゼの基質特異性の解析に利用しました。このように、質量分析法は酵素反応の生成物を直接同定するうえで有用であると言えます。
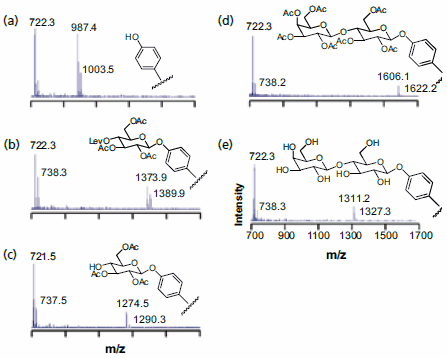
図3基板の単分子層上に二糖類を合成する各段階後における表面のSAMDI MSスペクトル。(a)フェノール基を有する単分子層;(b)最初の単糖類のカップリング;(c)保護基のレブリン酸エステルの選択的除去;(d)二番目の単糖類のカップリング;(e)最後の脱保護。
3番目の例では、DNAオリゴヌクレオチドの反応を扱います。現在、幾万もの異なる配列を含むDNAアレイが培養細胞の遺伝子発現パターンの解析に一般的に用いられており、最近ではタンパク質とDNAとの結合相互作用を特定するために用いられています18。このアレイは結合相互作用を検出するために蛍光標識が使用されているため、反応性の低分子化合物でDNAを処理して得られる共有結合付加物などの化学反応性を調べる研究には適用できません。SAMDIを利用して固定化したDNAの反応を評価するには、まず、トリ(エチレングリコール)基のバッググラウンドに対して5%の密度でマレイミド基が存在する単分子層を用意します19。DNAを結合させるため、末端にビオチンを有するアルカンチオールを最初に固定化したのちに、タンパク質のストレプトアビジンを結合させた表面を作製、ビオチン標識二本鎖オリゴヌクレオチドを捕捉しました。この一連の二本鎖を抗癌剤であるシスプラチンで処理し、その反応によって形成される一付加物や二付加物をSAMDIによって同定しました(図4)。SAMDI法の柔軟性とDNAアレイの確立された方法によって、アレイを用いる応用分野が大きく広がる可能性があります。
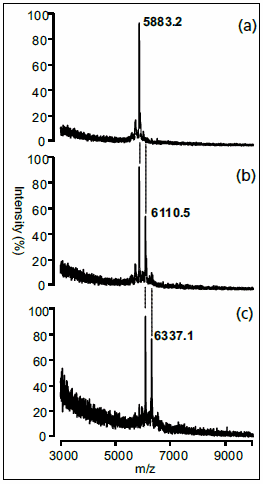
図4ビオチン化された二本鎖DNA(5’-ビオチン-TTT TAT ATA CGT ATA TCG)とシスプラチン(cis-[Pt(NH2)2Cl2])との反応生成物のSAMDI MSスペクトル。反応時間:0時間(A)、4時間(B)、21時間(C)。
以上の例から、自己組織化単分子層の界面反応の生成物と収率を迅速に評価できるSAMDIの有用性がおわかりいただけたと思います。合成量の多い分子ならNMR法やX線回折法で分析できますが、表面に結合した分子の構造に関する総合的な情報を提供できる方法やその組み合わせは未だにありません。現在、表面化学の研究では界面構造を把握するために(多くの場合は不完全ですが)、官能基を同定する赤外分光法、元素組成を決定するX線光電子分光法、単分子層の膜厚を測定する偏光解析法(ellipsometry)などのいくつかの方法を組み合わせて利用しています。SAMDIは、アルカンチオールを用いることでこれらの方法を補足し、他の方法では得られない分子の情報をもたらします。重要な点は、この方法が簡単に使用できること、単分子層上での様々な化学反応の開発・実行に利用できる情報が得られることです。この利点により、将来、様々な分野の基礎・応用研究に利用可能な複雑な構造を有する表面を開発できることでしょう。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?