静脈内薬物送達に見られる課題の1つに、薬物の低い溶解性が挙げられます。このような薬物は大量の生理食塩水で溶解させる必要があるため、臨床での利用が制限されます。この解決策の一つとして最近関心を集めているのが、薬物内包ミセルの利用です(本稿での「ミセル」とは、直径が<1 μmの球状構造体を指します。ナノ粒子やリポソームと呼ばれることも多く、薬物を充填することができます)。薬物はミセル内で高い溶解性を有し、ミセルは溶媒に対して高い溶解性を示すため、低溶解性の問題を解決できます。ポリ(エチレングリコール)(PEG)のような親水性ブロックと、アルキル鎖、ポリ乳酸またはポリグリコール酸のような疎水性ブロックからなる両親媒性ジブロック共重合体には、ミセルを形成する特徴があります。図1は、疎水性薬物がミセル内のポリマー疎水性ブロックに囲まれる様子と、親水性溶媒における親水性PEGブロックポリマーの状態の模式図です。溶媒(通常の生物学的アプリケーションでは水または生理食塩水)では、疎水性化合物の溶解性が限定されるにもかかわらず、ポリマーブロックがミセルの形状へと相分離することにより、疎水性分子が疎水性コアに溶解できる環境が作り出されます。一方で、in vivo試験を行なう場合には生体適合性ポリマーの選択が非常に重要となります。PEGは生体適合性の親水性ポリマーとして一般に使用されており、また、ポリ乳酸(PLA)およびポリグリコール酸(PGA)は経時的に酸へと分解し、生体内から問題なく排出されます1-4。
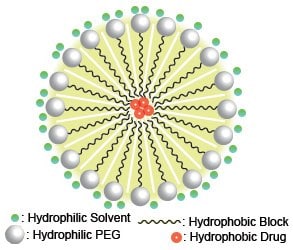
図1共重合体ポリマーによる薬物内包ミセルの例
クマリン6(C6)は、その優れた蛍光特性により、レーザー色素として用いられてきました。しかし、最近では薬物の放出制御や局所的な送達などの研究において、疎水性モデル化合物としても使用されています。C6は水への溶解性が0.25 μg/mLであるため、パクリタキセルやエベロリムスをはじめとする疎水性薬物の良いモデル化合物です。また、明るい黄色を示すため、送達の様子を肉眼で容易に観察できます。
ポリエチレングリコール-ポリ乳酸(PEG-PLA)ジブロック共重合体を用いた水中での疎水性薬物モデル(クマリン6)の溶解性試験
Poly(ethylene glycol) methyl ether-block-poly(D,L-lactide)decane(mPEG-PDLLA-decyl、764736)は、親水性PEGおよびアルキル(C10)末端基を有する疎水性ポリ(DL-ラクチド)(PDLLA)からなるジブロック共重合体です。各ブロックの分子量は、PEGが2,000 Da、PDLLAは2,000 Daです。末端アルキル基の役割は、ミセル内部の疎水性と可溶化特性を向上させること(より高い薬物充填能)にあります。また、このポリマーは水に最大で10%(w/v)まで溶解するため、溶液への薬物の溶解性が向上します。
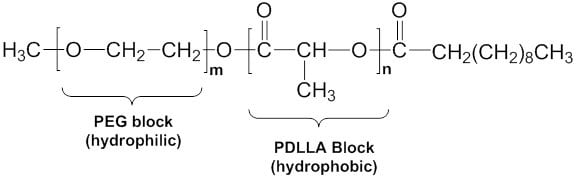
図2mPEG-PDLLA-decylの一般構造
試験方法
まず、過剰量のクマリン6(C6)を、複数の2 mLマイクロチューブに加えました。各チューブにテスト溶液を約1.5 mL加え、直立状態にて37℃、120 RPMの振盪撹拌により一晩インキュベートし、平衡化させました。翌日、予熱したシリンジで各溶液1 mLを吸引し、次にその液を0.45 μmのPVDFフィルタを介して押し出すことにより、微粒子を除去しました。フィルタ濾過した溶液をエタノール1 mLで希釈し、Genesys20分光光度計で460 nmの吸収度を測定しました。その吸収度を、純エタノールで希釈調製した幾つかの既知濃度のC6標準液セットと比較し、各溶液ごとのC6濃度を算出しました。
本方法は、使用する1週間前から水中にて37℃でインキュベートした1%(w/v)のmPEG-PDLLA-decyl溶液、および使用直前に溶解したmPEG-PDLLA-decylに対しても適用しました。すべてのテストは3回行われ、95%信頼水準でのt検定により信頼値を算出しました。
結果
以下の図3に示した結果は、一晩振盪した直後のmPEG-PDLLA-decylの水中濃度%(w/v)と得られたC6の溶解性との関係を示しています。
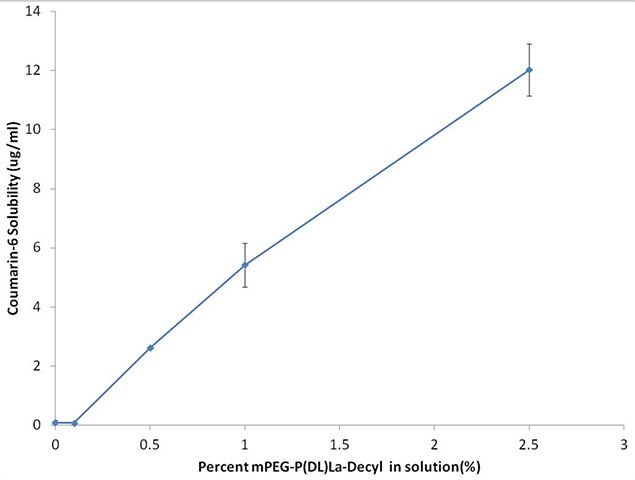
図3クマリン6(C6)の溶解性は、水中のmPEG-PDLLA-decylの濃度上昇とともに増加しています。エラーバーは、95%信頼水準でのt検定を基にしています。
このように、ポリマー濃度が0.1%~2.5%の範囲において、C6の溶解性がポリマー濃度の上昇につれて直線的に増加する様子が見られます。その溶解性は、2.5% w/v mPEG-PDLLA-decylの添加により1 μg/mL未満(純粋な水に対して)から10 μg/mL以上に増加し、40~50倍に増加することを示しています。次に、ミセルの可溶化力の経時変化について確認しました。mPEG-PDLLA-decylにおけるC6の溶解性は、一晩振盪した直後で5.42 ± 0.74 μg/mL、37℃で1週間インキュベーションした後では4.85 ± 0.46 μg/mLでした。この差異は、統計学的に有意なものではなく、37℃、1週間の経過でごくわずかしか減少しなかったことを示しているに過ぎません。
mPEG-PLGAジブロック共重合体を用いた薬物内包ミセルの形成
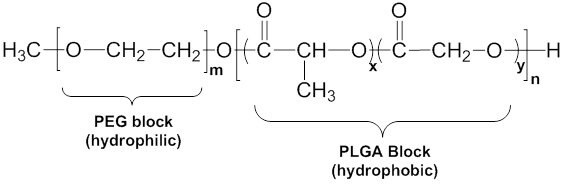
図4 mPEG-PLGAの一般構造
mPEG-PLGA(図4)は、末端がメトキシ基の親水性ブロック(PEG)と、末端がヒドロキシル基のポリ(ラクチド-co-グリコール酸)(PLGA)疎水性ブロックとのブロック共重合体です。表2に示すように、異なる分子量やブロック比の様々なポリマーを入手することができます。分子量、ブロック長、およびブロック比の違いは、溶解性やミセル特性に影響を与えます。PLGA/PEGブロック重量比が高い場合(すなわち、疎水性PLGA部分を多く含むポリマー)、ポリマーは水に溶解しません。このようなポリマーは、ジクロロメタン(DCM)のような有機溶媒にのみ溶解します。PLGA/PEGブロック重量比が低くなるにつれて共重合体の溶解性は増加するため、溶解特性を効果的に調整することで、特定の溶解性と粒径を有するミセルを作製することができます。

図5撹拌の様子
方法
ポリマ-薬物溶液
mPEG-PLGAポリマーを5%(w/v)濃度となるようにDCMに溶解します。これとは別に、2.5%(w/v)のC6をDCMに溶解し、このC6溶液0.1 mLをポリマー溶液1 mLに加えます。これにより、ポリマーに対する薬物の最終比率が5%(w/w)の薬物/ポリマー溶液が調製されます。比較のため、DCM(ポリマー不含)にC6を混合した溶液をネガティブコントロールとして用います。
Liposomes
22 mLシンチレーションバイアルを、蒸留水20 mLで満たします。スクリュードライブを備えたオーバーヘッドスターラーを用い、2000 RPMの速度で撹拌します(図5)。撹拌しながら、各ポリマー薬物溶液1.1 mLを100 μLずつ加え、混合液/溶液を1時間以上攪拌することによりDCMを蒸発させます。
スクリーニング
肉眼で見えるあく状の不純物層(scum layer)を除くために、折り畳んだ濾紙(良質で固いもの)に各溶液を通して自然濾過します。続いて、各溶液をシリンジに吸引し、0.45 μm(450 nm)のPVDFフィルタを介して押し出し、微粒子状物質を除去します。フィルタ濾過した溶液は、径が450 nmを超える物質がすべて除かれたことから、リポソーム溶液であるとみなしました(図6)。

図6粒径によるスクリーニング
スクリーニングした後、2000 RPMで1分間遠心分離し、一晩静置させることにより、溶液の安定性を簡単に確認しました。
結果
フィルタ濾過した直後、mPEG-PLGA共重合体を含む溶液、および含まない溶液の目視検査をしました(図7)。写真のとおり、可溶化共重合体を含んでいる左の溶液は、目視で確認できる濃度の黄色のC6を含有していることがわかります。右の溶液は可溶化共重合体を含まないネガティブコントロールであり、C6を含有していません。フィルタ濾過により、ほぼすべてのC6が除去されたためです。mPEG-PLGAが存在しない場合、C6は水への溶解性を失います。しかし、ミセル形成ポリマーとともに溶解すると、水溶性のミセル中にC6が溶解するため、結果的にC6は水に残留することになります。

図7安定化ポリマーを含むC6溶液と安定化ポリマーを含むC6溶液(左)と安定化ポリマーを含まないC6溶液(右)の外観の比較
これらを1:10でエタノールに希釈した後、紫外/可視分光計でC6の吸収波長469 nmの吸光度を測定し、既知濃度の標準液と比較することによりC6含有量が得られます(表3)。なお、本結果は単に上記プロトコルを基に得られた濃度であり、ポリマーの最大充填量を表しているとは限らないことに注意してください。さらに、2000 RPMで1分間遠心分離することにより本材料の安定性をテストしたところ、沈澱がまったく見られないため、C6は水相に均一に分散し、沈澱せずに安定であることが示されました。
結論
Poly(ethylene glycol) methyl ether-block-poly(D,L-lactide) decane(mPEG-PDLLA-decyl)およびmethoxypoly(ethylene glycol)-block-poly(lactide-co-glycolide) (mPEG-PLGA)などのジブロック共重合体は、ミセルを形成し、クマリン-6(C6)のような疎水性分子の溶解性を高めます。共重合体の装填量を増やすとC6の溶解性は高まり、最短で1週間、統計学的に一定の溶解性を維持することが示されました。PLGA/PEGブロック重量比が低くなるにつれて共重合体の溶解性は増加するため、溶解特性を効果的に調整することで、特定の溶解性と粒径を有するミセルを作製することができます。こうした共重合体の制御可能な特性は、疎水性薬物を送達する新技術の開発にとって極めて重要です。
使用上の注意・免責事項
この製品は試験研究用であり、医薬品、家庭用、その他の用途では使用できません。。危険有害性および安全な取り扱いについては、安全データシートをご覧ください。
保管条件および安定性
ポリマーは水分と接触すると生分解されます。乾燥剤の存在下、-20℃で保存してください。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?