RESOMER® - 縫合糸、医療用デバイス、薬物送達システム、組織工学用の生分解性ポリマー
Karsten Mäder
Institute of Pharmacy Martin-Luther-University Halle-Wittenberg
はじめに
分解反応の制御された合成ポリマーは、1960年代後半に環境保全上の理由から開発されました。その後、生分解性ポリマーの生物医学的な応用への関心が急速に高まり、現在も新規材料設計に焦点を当てた研究が続けられています。生分解性ポリマーは、エステルやアミド、無水物などのさまざまな官能基を用いることで、目的にあわせて分解反応を制御することができます。中でも図1に示したグリコリド(1)やラクチド(2)から合成されたポリエステル類が特に注目されているのは、これらが生体システム内で耐性が高く、特徴的で調整可能な物理化学的、機械的性質をもつためです。 多くの場合、ポリグリコリド(PGA)(3)やポリラクチド(PLA)(4)の合成には、グリコリド、ラクチドの開環重合が用いられます。 これらの分解生成物は、それぞれ主にグリコール酸(5)と乳酸(6)です。
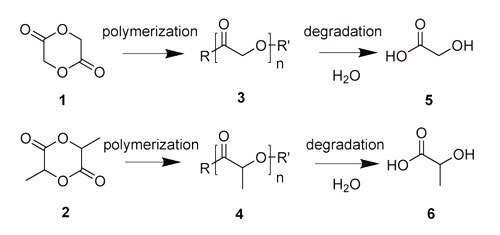
図1グリコリド(1)とラクチド(2)、および対応するポリマーであるポリグリコリド(PGA)(3)とポリラクチド(PLA)(4)、分解生成物のグリコール酸(5)と乳酸(6)の化学構造。
多くの生物医学用途には特有の要件が求められており、信頼性の高い予測可能な特性を得るためには高品質の材料が必要不可欠です。こうしたポリマーに求められる品質には、狭い分子量分布をもち、残留モノマーの含有量が低く、不純物が最小限で、明確に定義された化学構造であることなどが挙げられます。求められるパラメータをリビング開環重合によって制御することで、特定の用途に必要な、明確に定義された性質を持つポリマーを設計することが可能です。歴史的には、生物医学用に応用された最初の生分解性ポリマーはポリヒドロキシエステルで、生分解性縫合材料として利用されてきました。その後、他の新たな生分解性ポリマーが開発され、生分解性医療用デバイス(スクリュー、プレート、ステント)への利用、薬物担体、組織工学用材料をはじめとする応用例が見出されています。目的とする用途によって、求められる分解速度は数日から数年にわたります。
RESOMER® ポリマーは生体吸収性の脂肪族ポリエステルで、ラクチドとグリコリドの多様なモノマー比率、PLA立体化学、末端の官能基化などの特徴を持っています。そして、ラクチドとグリコリドからなるこの生分解性ホモポリマーや共重合体は、分解時間の長い非常に硬い半結晶質の物質から、分解速度のより速い柔らかな非晶質の物質まで、さまざまな性質を示します。その一般的な特性を表1にまとめました。
分解
水によってRESOMER® ポリマーは加水分解を起こします。図2はRESOMER® ポリマーの生分解の各過程を図解したものです。 第1段階では、表面が湿潤し、水がポリマー内部に拡散していきます。拡散速度は、多孔度、細孔径、表面張力によって決まります。第2段階では、エステル結合の加水分解によってより長さの短い鎖へ開裂されます(ポリマー分解)。より分解が進むと、短い鎖の断片(100 g/mole未満)が溶解を始め、ポリマーエロージョン(侵食)が起こります(第3段階)。その後、可溶化したモノマー/オリゴマーは腎臓から排出、あるいは二酸化炭素と水に代謝されます(第4段階)。このように、プロセスの最後の段階でポリマーは完全に吸収され、体外へと排せつされます。生分解性ポリマーのライフサイクルが終了(固定化や薬剤放出など)した後は、ポリマーは完全に分解することが強く求められます。RESOMER® ポリマー固有の特徴に「完全な分解」がありますが、これはモノマーが非常に水に溶けやすいためです。これに対し、ポリ酸無水物のような疎水性モノマーは溶解度が低いため、ポリマー分解後も局所的に長期間残存する傾向があります1,2。
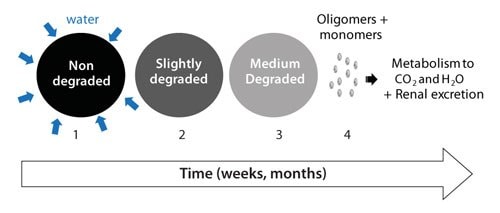
図2RESOMER®ポリマー分解の各段階。(1)水による湿潤とその拡散(2)分子量の減少(ポリマーの分解)(3)質量損失(ポリマーエロージョン)(4)腎排せつまたは、二酸化炭素と水への代謝
共重合体や添加剤の処理や導入により、ポリマー固有の性質に加えて、生分解性デバイスの最終的な性能や滞留時間を目的に合わせて調整することができます。例えば、両親媒性物質をデバイスに組み込めば湿潤性が向上し、多孔度を高める処理によって水の浸透は増加します。また、治療薬などの内包物質の濃度や粒径分布によっても図2に示した分解過程の速度パラメータが変化し、さらに、強アルカリ性あるいは強酸性の物質はポリマーの分解を促進します。このように、ポリマー内部のミクロ環境は放出過程や分解過程における重要な要因であり、例えばPLGAインプラント内のpHは、in vivo でpH 2まで下がることが明らかになっています3。Schwendemann、Siepmann、Göpferichらの複数のグループによる研究からは、(i)分解は多くの場合不均一で、送達系の中心部の方がより速く進み、(ii)マイクロ粒子内には酸性のpH環境も存在し、(iii)治療薬や緩衝物質がミクロ環境を変化させることがあるため、ポリマー分解や薬剤放出の反応速度にも変化が生じることがわかっています4-7。酸性のミクロ環境も、組み込んだ薬剤の効果を阻害する可能性があります。 最近の研究では、酸性のミクロ環境ではポリマーの分解生成物によるペプチド薬剤との共有結合的修飾が促進されますが、適切な塩を加えることによりpHの低下を防ぎ、ペプチドやタンパクの薬剤を安定化できることが報告されています8。
インプラントの作製
生分解性ポリエステル化合物からコーティング、インプラント、マイクロ粒子やナノ粒子、あるいはマイクロカプセルやナノカプセルを作製するには、いくつかの加工技術が用いられます。最も一般的に利用されるのは熱機械的処理あるいは溶液促進法です(図3)。

図3RESOMER®ポリマーを制御放出用材料に応用する際の、最も一般的な作製方法と典型的な粒径
溶融押出は、縫合糸やあらかじめ成形されたインプラントの作製に用いられている方法の1つです。ほとんどのRESOMERポリマーには穏やかな熱処理が行われます。例えばRESOMER® Xのガラス転移温度(Tg)は約50℃です。ペプチドを担持した、成形済みのPLGAあるいはPLAインプラントは、1~6カ月のデポ製剤として、ホルモン感受性の前立腺がんや乳がんの治療に広く使われています。デポ製剤は、皮下あるいは筋肉内に注射され、内部の薬剤は長期間にわたって制御された状態で放出されます。最近では眼の黄斑浮腫の治療用に、小型のデキサメタゾン担持PLGA硝子体内インプラントが上市されています9。
その他のインプラントの作製方法に、in situ での合成があります。 この方法では、生分解性のPLGAポリマーやPLAポリマーを生体適合性の有機溶媒に溶かし、患者に注射します。in situ インプラント形成は、成形済みのインプラントに比べて簡便かつ加工コストが低くすみます。 さらに、この方法では細い針を使用できるため、患者にとっては明らかな利点となります。しかしながら、出来上がったインプラントの大きさや形状は非常にばらつきが大きく、また、用いる手法や周囲の組織状態に大きく左右されます。加えて、初期バースト放出が高く、制御が困難です。
治療薬を送達するもう1つの方法は、マイクロ粒子へのカプセル化です。マイクロ粒子は通常、親水性または疎水性薬剤の非経口投与に用いられます。担持マイクロ粒子は、噴霧乾燥法、コアセルベーション法、あるいはエマルション溶媒蒸発法によって調製されます。薬剤は、マイクロ粒子中に可溶化もしくは分散させます。放出特性は、マイクロ粒子の粒径分布と多孔度、薬剤の特徴と濃度、および放出条件に依存し、多くの場合、(1)初期バースト放出に続いて(2)徐放期間と(3)放出が加速される最終放出期があります。最終段階にて薬剤放出が加速されるのは、ポリエステルの自己触媒的分解によって粒子内に酸性のミクロ環境が形成されるためです。放出特性は、適切な合成パラメータによって調整され、例えば、線形放出、バースト放出をしないパルス放出(予防接種用途など)、調整可能な遅延放出などが実現可能です。
RESOMER® ポリマーは、ナノ粒子あるいはナノカプセルとしても作製が可能であり、この場合の投与方法は主に点滴注射です。ナノ粒子は診断目的もしくは腫瘍の治療に使われます。ナノサイズポリエステルのそれ以外の投与法には、経口、経皮、経肺、点眼による薬物送達があります。PLA/PLGAを用いたナノ粒子の経口投与により、炎症組織のみに薬剤を送達し、副作用を減らし、治療の効果を高めることができるようになります。さらに、組織表面での滞留時間が長くなることが確認されています。
PEG化
このように、PLA/PLGA共重合体は非常に幅広い応用が可能ですが、ポリエステルへのポリエチレングリコールの導入による化学修飾(PEG化)を行うことにより、新たな応用の道が開けます。図4に示すように、PEG化は分解やエロージョンに大きな影響を与えます。 PLGAの場合、分解はエロージョンが生じる約3週間前に起こります。エロージョンは分子量が7,000~8,000 g/moleまで低下した時点で始まり、比較的急激に進みます。一方で、PEG化PLGA共重合体(PEG-PLGA)では、分解とエロージョンの間に時間的な差がありません。初期の段階では、予想されるとおり、より親水性の強いPEG-PLGAでエロージョンが速く進みますが、最終的な質量減少はPLGAの方がはるかに短時間で進みます。PLGAのこの非線形的な挙動は、その自己触媒的分解とPLGA内部の酸性ミクロ環境によって説明されます。
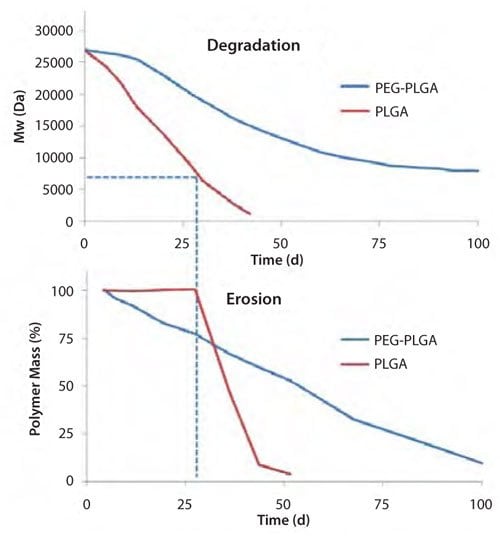
図4PLGAとPEG-PLGAポリマーの分解(上)とエロージョン(下)の典型的な経時変化10-12
導入したPEGの割合が低い場合でも水の浸透は加速され、低分子量の分解生成物(一般的には酸)が急速に拡散します。その結果、酸性のミクロ環境が弱まることで自己触媒の影響が減少し、分解速度が遅くなります。
治療薬の放出速度もまた、PEG化RESOMER® ポリマーを用いることで目的に合わせて調整することができます。低分子量の薬剤はPEG化RESOMER® ポリマーから急激に放出されますが、大きなペプチドやタンパク質は1日から数週間かけて放出されます。PEG化によってポリマーの親水性は増加し、親水性PEGと疎水性PLA/PLGAブロックの鎖長や割合を変えることによって、親水性を調整することができます。一方で、PEGの割合が高い場合は、共重合体はミセルを形成し、バランスの取れた親水性であれば、ポリマーはラメラ相となります。また、PEGの割合が低い(<30%)ポリマーは自己可溶性でなく、ナノまたはマイクロ粒子、あるいはインプラントを作りますが、PEG-PLAとPEG-PLGAが相分離するため、親水性のナノ領域が存在します。このナノ領域は、タンパク質にとっては好ましい環境です。さらに、多くの論文に示されているように、初期バースト放出の低減によって制御しながらタンパク質を放出できる点、全体の放出特性をはるかによく制御できる点、タンパク質の活性を保持できる点などにおいて、PEG-PLAやPEG-PLGAポリマーの方がPLAやPLGAに比べて優れています。PEGの導入は、水の浸透性、ポリマーの分解、放出特性に非常に大きな影響を与え、例えば、PEG-PLGAマイクロ粒子への水の浸透は非常に速く、このためタンパク質の可溶化も速くなることが知られています。低分子量化合物は速やかに放出されますが、タンパク質はPEG-PLGAマイクロ粒子中のPEG鎖内に制限されるため、数日から数週間かけて制御放出されます。PEG-PLGAポリマーは初期に速く分解し、多くの場合、より線形的な分解とエロージョン特性を示します。反対に、純粋なPLAやPLGAのポリマーでは、水の浸透が遅いため初期に時間的な遅れが生じることがよくあります。しかし、非常に多くの場合自己触媒作用が起こり、より酸性のミクロ環境となることで分解が加速されます。そのため、PLAポリマーやPLGAポリマーは疎水性が高いにもかかわらず、より速く分解します。異なる合成方法を用いたり適切なPEG含有量や鎖長を選ぶことで、PEG化ポリマーに所望の放出特性を持たせることができます。
PEG化RESOMER® は、骨形態形成タンパクII(BMP II)のカプセル化に利用されています13。このマイクロ粒子は、調整可能な制御放出特性をもち、皮下注射するとin vivo での骨形成が誘発されます。また、PEG化RESOMER® は、乳化剤を含まないナノ粒子やナノカプセルの作製にも用いられます。この場合、生体システムとの相互反応を抑制するPEGのステルス効果のため、粒子が長い滞留時間を示すことが知られています。結論として、RESOMER® ポリマーは、広い分野に応用可能な、生分解性を持つ多様な素材であり、ポリマーの化学組成を適切に選択し、個々に合わせた合成法を利用すれば、目的の用途に適した所望の性質が得られます。PEG化RESOMER® ポリマーの開発によって、生物薬剤学の分野に新たな応用がもたらされるでしょう。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?