はじめに
ポリラクチド、ポリ(ラクチド-co-グリセリド)、ポリカプロラクトンなどの脂肪族ポリエステルやこれらの共重合体は、多様な合成生分解性高分子を代表する化合物で、医療用に広く研究されており、市販もされています1。これらポリエステルは体内での利用に不可欠な優れた組織親和性と安全性を有し、米国食品医薬品局(FDA:Food and Drug Administration)と欧州医薬品庁(EMA:European Medicine Agency)により、薬物送達用デバイス、縫合糸、インプラントなどの多くの生物医学用途での使用が認められている高分子です。生分解性高分子ナノ粒子は、バイオアベイラビリティ(生物学的利用能)や生理活性、送達の制御を向上させるために、疎水性および親水性薬物を送達する担体として精力的に研究されています。本稿では、薬物送達で利用されているポリエステルを基盤としたさまざまな生分解性高分子について紹介し、生理化学的性質や、高分子ナノ粒子の合成に利用されている方法、さらには、これらの材料の分解プロセスについて述べます。
生分解性ポリエステル
ポリラクチドは再生可能資源に由来する熱可塑性生分解性ポリエステルで、その性質はモノマーの光学活性に左右されます。乳酸(またはラクチド)モノマーは、2つの光学異性体、つまりD体およびL体をとるキラル分子であり、「ポリラクチド」には、ポリ(L-ラクチド)(PLLA)、ポリ(D-ラクチド)(PDLA)、およびD体とL体の両方を含むポリ(D,L-ラクチド)(PDLLA)が存在します。PLLA含有率が>90%のポリラクチドが結晶となることが多いのに対し、PDLLAは、高分子鎖中に2つの異性体モノマーがランダムに含まれているためにアモルファス高分子となります。高い機械的性質が必要とされる場合(引張強度が50~70MPa)には、アモルファスよりも半結晶性ポリラクチドの方が一般的に適した材料です。ポリラクチドのガラス転移温度(Tg)および融度(Tm)は、それぞれ50~65°Cおよび175~180°Cの範囲にあり、L-ラクチド含有率が高ければこれらの遷移温度は高くなります。
ポリ(ラクチド-co-グリコリド)(PLGA)はランダム共重合体で、ラクチドとグリコリドの比率を変えることで容易に物理的、機械的性質を調整することができます。PLGA共重合体のTgは体温(37℃)よりも高く、そのため通常はガラス状の形状をとります。25~75%のラクチドからなるPLGAは、アモルファスで加水分解を受けやすいため、薬物送達用の有力な候補材料です。さらに、PLGAは細胞接着性と細胞増殖性に優れており、組織工学でも利用されています。最近、Danhierらによる総括的なレビューにおいて、PLGAを基盤とする生物医学用ナノ粒子について詳述されています2。修飾済みPLGAナノ粒子は血液脳関門を通過することができることから、中枢神経系への薬物送達に利用できる可能性をもっています。
ポリ(ε-カプロラクトン)(PCL)は半結晶性高分子で、引張強度が低く(約23 MPa)、低いTg(約-60°C)とTm(約55~60°C)を有しています。生理条件下でPCLはポリラクチドよりもゆっくりと分解するため、長期埋め込み型デバイス作製用の弾性材料として、組織工学用途で数多く用いられています3,4。PCLを基盤とするナノ粒子は、制御された薬物送達システムでの利用についても広く研究されています5。
高分子ナノ粒子の合成方法
生分解性高分子からなるナノ粒子は、薬物送達用として大きな関心を集めています。DNAやタンパク質などの非常に多様な親水性および疎水性の薬物分子を生分解性高分子でカプセル化し、ナノ粒子の形態で特定の器官や細胞まで送達することができます6。過去数十年の間に、ポリエステルを基盤とする粒子(またはカプセル)の合成方法がいくつか発表されています。どの手法を選択するかは、主に、高分子の生理化学的性質(溶解度や分子量)や導入する生物活性物質の生理化学的性質(薬物の疎水性/親水性や、溶媒に対する反応性)によって決まります。現在、最もよく用いられている方法は、エマルション/溶媒蒸発法または拡散法、二重エマルション法、フラッシュナノ沈殿法、および塩析法であり、それぞれについて以下に解説します。
「エマルション/溶媒蒸発法」では、高分子と疎水性生体材料(薬物など)とを含有する少量の非極性有機溶媒(油相)を、安定剤を含む極性溶媒(水相)に添加して、水中油型エマルションを調製します7-9。最もよく用いられる安定剤は、ポリ(ビニルアルコール)、ポリソルベート(TWEEN®)、ポリ(アクリル酸)、ポロキサマー(またはPluronic®)、およびドデシル硫酸ナトリウムです。高温下または減圧下で有機溶媒を蒸発させることで、水相中に安定なナノ粒子が形成されます。「エマルション拡散法」では、油相は、若干の水溶性を持つ有機溶媒(酢酸エチル、炭酸プロピレンなど)に溶解させた高分子からなります10,11。水中油型エマルションに一定量の水を添加すると、系の平衡が変化し、有機溶媒が油相粒子内部から水相へと拡散します。その結果、高分子の溶解度が低下し、粒子が形成されます。
別の手法として、「二重エマルション(水中油中水型)法」があります12,13。二重エマルション法の主な利点は、親水性薬物を効率よくカプセル化できる点にあります。まず、水中に溶解させた薬物を高分子を含む有機溶媒に加えて、油中水型エマルションを作製します。ついで、少量のこのエマルションを、粒子を安定化させるためのPVAなどの乳化剤を含む異なる水相に加えます。有機溶媒を蒸発させることで、親水性薬物を含有した高分子ナノ粒子が得られます。「ナノ沈殿(または溶媒置換)法」では、ナノ粒子の作製に高分子の界面析出を利用します14。この方法では、高分子および疎油性薬物を水溶性有機溶媒(アセトンなどの半極性溶媒)に溶解させ、この溶液を安定剤を含む水溶液に加えます。溶媒拡散によって、水相と細かく分散した油滴との界面で高分子析出が起こり、固体粒子が形成されます。最後に、「塩析法」では、安定剤と高濃度の塩(塩化マグネシウム六水和物など)を含む水相と、アセトンやテトラヒドロフランなどの水溶性有機溶媒中に溶解させた高分子とで構成される、水中油型エマルションを調製します15。塩の濃度が高いため、水相への溶媒の拡散は起こりません。この水中油型エマルションに、大量の水を素早く添加すると、イオン強度が低下して水溶性有機溶媒が水相へ移動し、固体粒子が形成されます。この方法の場合、利用する前に残存している塩と溶媒とを除去し、粒子を精製する必要があります。得られるナノ粒子/カプセルの大きさは、調製方法のみならず用いる高分子の分子量や親水性/疎水性の性質に大きく左右されます。
エマルション/溶媒蒸発法とミニエマルション法との組み合わせ
「エマルション/溶媒蒸発法」と「ミニエマルション法」とを組み合わせることで、サイズを制御し、粒度分布の狭い生分解性ナノ粒子を作製することができます16,17。この方法では、高分子を含む非水溶性有機相と親水性安定剤を含む水相とを用いて乳化を行います。高いせん断力によって直径が約50~500 nmの単分散ナノ液滴が形成され、ミニエマルションが得られます。続いて、この系から有機溶媒を蒸発させると球状のナノリアクター内に高分子が沈殿し、サイズの制御された固体粒子が形成されます。その合成方法をスキーム1に示します。
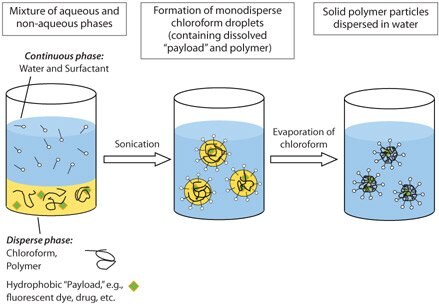
スキーム1 水中油型ミニエマルジョン法による、生分解性ナノ粒子の合成
アニオン性ドデシル硫酸ナトリウム(SDS:sodium dodecyl sulfate)で安定化したナノ粒子の合成(スキーム1)に用いた、5種類の高分子を表1に示します。用いた高分子の分子量および種類が、ナノ粒子のサイズや粒度分布にもたらす影響について調べました。ナノ粒子は、72 mgのSDSと、0.3 gの高分子とを用いて調製しました。
これらの高分子を用いて調製したナノ粒子の直径の範囲は、76~165 nmでした。最も小さな粒子が得られたのはPLGAを用いた場合で、最も大きな粒子はPCL-2を用いた際に得られました。安定剤としてSDSを用いたこの方法では、分子量が高いほど大きな粒子が形成される傾向にありました(PLLA-1:121 nm、PLLA-2:106 nm)高分子ナノ粒子の形態は、走査電子顕微鏡(SEM:scanning electron microscopy)を用いて確認し、すべての粒子は球状で、低い多分散性を示すことがわかりました。代表的な例として、PLLA-1粒子を図1に示します。

図1 PLLA-1のSEM画像。球状で低い多分散性をもつことがわかります。
高分子粒子の担持効率は、疎水性蛍光色素マーカー(PMI:N-(2,6-diisopropylphenyl)-perylene-3,4-dicarbonacidimide)をモデル化合物に用いて確認しました。高分子1 gあたり0.5~2.98 mgのPMIを含有する、一連の高分子ナノ粒子を調製しました。しかし、粒子の精製後、カプセル化したPMIの最終的な濃度は、用いた高分子の種類にかかわらず高分子1 gあたり約0.7 mgでした。ナノ粒子のもつ負の表面電荷を利用して、リン酸カルシウムのバイオミメティックミネラリゼーション用テンプレートとしてこれらナノ粒子が用いられています18。
ナノ粒子の分解プロセス
脂肪族ポリエステルの分解は、化学的な加水分解、微生物分解、酵素分解、熱分解などが、単独もしくは組み合わさって進行します19。加水分解は水の吸収によって始まり、エステル結合の加水分解開裂が起こります。高分子の加水分解は、化学構造(結晶化度や疎水性など)や分子量および分子量分布純度、形態、加工方法、保管条件(温度、pH、塩の存在など)といったさまざまな要因の影響を受けます20。ポリカプロラクトンは、少なくとも2つの段階を経て分解されます。第1の段階で、エステル結合の非酵素的なバルク加水分解が起こり、高分子鎖の炭素末端による自触媒作用を受けます。この段階では、PCLの形状と重量に変化は見られません。分子量が約5,000 g/molの単位までPCLが分解されると、第2段階が始まります。この時点で鎖の切断速度は低下し、高分子マトリックスからのオリゴマーの拡散によって、重量は減少し続けます。PLGA高分子は、乳酸とグリコール酸に分解され、二酸化炭素および水として体外へと排出されます。
PLLA-1、PLLA-2、PCL-1、PCL-2、およびPLGA粒子の分解を、重量平均分子量(Mw)の減少速度から推測しました。ミニエマルション形成時における超音波処理(US:ultrasonication)が高分子の分解を引き起こすことを考慮し、超音波処理を行わずに調製した粒子のMWも確認しました。保管期間に対する重量減少の相対値の変化を図2に示します。

図2 異なる種類と分子量の高分子を用いて測定した分子量の経時変化。超音波処理(US)の前および直後、ならびにUSから45日後、150日後、285日後に分子量を測定しました。
超音波処理によってすべての粒子が分子量減少を示し、特にPCLは70~75 wt.%の分子量減少を示しました。初期分子量の大きな高分子(PLLA-1およびPCL-1)では、分子鎖長の短い高分子(PLLA-2およびPCL-2)に比べて、超音波処理による減少が顕著にみられました。この重量減少率の違いは、超音波処理中に系に高いせん断力が生じたことにより、鎖の絡み合いをより多く含む高分子では熱分解が加速されたためであると考えられます。また、時間が経つにつれて分子量が急速に低下するのは、エステル結合のランダムな加水分解開裂の結果であり、アモルファスPLGA粒子の分解速度が他の高分子に比べて僅かに速いのは、高い浸透性のためです。12カ月以上経過したのち、PLLA、PCL、PLGAナノ粒子の分子量はそれぞれ51、78、54 wt.%低下しましたが、分子量が低下したにもかかわらず、粒子サイズには大きな変化が認められませんでした。
結論
生分解性合成ポリエステルについては、これまでに膨大な数の研究が行われています。ポリエステルを基盤としたナノ粒子は、最も汎用性の高い有望な生体材料の1つであり、生物医学用途における特定の要件を満たすように合成することができます。高分子をナノ粒子として調製することで、親水性薬物、疎水性薬物、ワクチン、タンパク質、核酸のように、カプセル化する薬物の種類をコントロールできます2。ポリエステルベースのナノ粒子(大きさは50~500 nmの範囲)に、パクリタキセル、シスプラチン、ヒペリシンなどの抗ガン剤をカプセル化することで薬物単独の場合と比較して、抗腫瘍効果は大きく向上します。この効果は、高分子材料が、カプセル化した薬物を酵素分解から効果的に保護するためであると考えられています。こうした保護効果に加えて、界面への薬物送達にナノ粒子を用いることもできます。例えば、ポリエステルベースのナノ粒子は、組織工学で作製した人工血管に増殖因子を送達することが可能であり、PLGAナノ粒子でコートしたステントは、血管壁に遺伝子や薬物を効果的に送達できます。さらに、高分子の組成や分子量を適切に選択すれば、カプセル化した薬物の分解速度や放出特性を広い範囲で調整することができます。粒子の形状、作製法、官能基化についての研究が進むことで新規の優れた生体材料が得られ、標的送達や治療診断(theragnotics)における開発が今後も進展していくことでしょう。
References
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?