COVID-19の世界的大流行によってワクチン研究は大きく加速しており、なかでも研究活動が最も進んでいるのはmRNAワクチンです。mRNAワクチンが効果を発揮するためには、標的部位にmRNAを送達するとともに、mRNAが体内で速やかに分解されないよう保護する担体が不可欠であり、脂質ナノ粒子(LNP:lipid nanoparticle)またはリポソームとしても知られる様々な脂質を用いた担体が開発されています。従来、脂質ベースの担体は長期間の試行錯誤による最適化を経て生産されますが、マイクロ流体力学を利用した新たなアプローチによって、ワクチン開発の初期段階を合理化することができます。NanoFabTx™試薬およびマイクロ流体デバイスキットは、様々なナノ粒子製剤をスクリーニングし、mRNAまたは薬物を内封した非臨床評価用リポソームを最終的に合成するためのready-to-useプラットフォームを提供します。
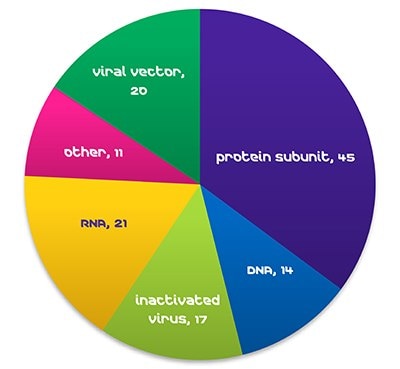
図1臨床開発段階にあるCOVID-19ワクチンの数(WHO、2021年10月29日現在)ワクチンの世界的需要は急拡大の一途をたどっており、比較的平常な時期においてもワクチン量の年間成長率は25%を超えています(WHO、2019年)。エボラ、MERS、SARSや、世界的に大流行しているCOVID-19といった新たなウイルスの出現により、ワクチン需要の急激な高まりとともに、開発短縮の必要性が強く求められています。2021年10月下旬時点で、RNAワクチンは、臨床開発段階にあるCOVID-19ワクチンの17%を占めています(WHO)。
mRNAワクチンとは?
化学的に合成されたmRNA(メッセンジャーRNA)ワクチンは、弱毒化または不活化した病原体を用いることが多い従来のワクチンとは異なり、病原体の一部を作るための設計図のみを細胞に運びます。病原体の断片が我々の細胞によって作られると、免疫系によって非自己と認識され、それ以降の感染から我々の体を防御する免疫応答が誘導されます。我々の細胞はmRNAワクチンから病原体全体を作ることができないため、高い安全性を示します。
さらに、mRNAワクチンは確実に免疫応答を誘導すること、また、健康者において良好な忍容性を示し、副作用が少ないことが確認されています。mRNAワクチンはラボで作製でき細胞培養を必要としないため、生産を迅速かつ標準化することができ、新たな感染症の流行への対応力を高めることができます。
RNAは壊れやすい分子であり、そのままの状態で投与すると、生体内に備わっている酵素プロセスによって分解されてしまう可能性があります。そのため、細胞内へのmRNA送達を成功させることが、mRNAワクチン開発における重要な課題となります。脂質担体(リポソームおよびLNP)へのmRNAの封入は、mRNAワクチンの細胞への導入および細胞質への送達を確実に成功させる理想的な方法です(図2)。
脂質担体を用いたmRNAワクチンの送達
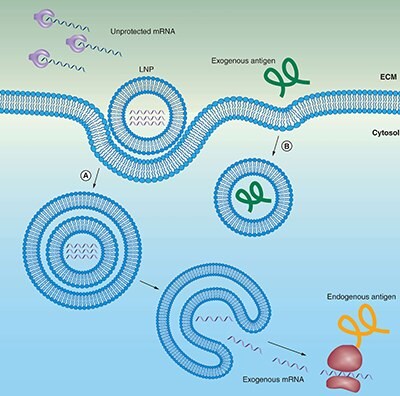
図2脂質担体(リポソーム)はmRNAを分解から保護するとともに、エンドサイトーシスおよびエンドソームからの脱出を促進します。
(A)mRNAをリポソームに封入することで、酵素による分解から保護されます。正に帯電するmRNA内封リポソームは、負に帯電する細胞膜に選択的に局在し、その後、エンドサイトーシスによって細胞質ゾルに取り込まれます。mRNAが細胞質に到達し転写されるためには、mRNAがエンドソームおよび脂質担体の両方から脱出する必要があります。
(B)細胞外タンパク質ベースのワクチンも同様にエンドサイトーシスを受けますが、エンドソームから脱出しなくても、MHCクラスII分子によって提示されます。
脂質担体の特長:
- 脂質ナノ担体は細胞膜の構造に極めて類似しています。
- 疎水性薬物、親水性薬物のいずれの送達にも使用できます。
- その組成とナノサイズの大きさであることから担体として有効であり、内部組織および細胞に到達し、医薬品有効成分、核酸、タンパク質、DNAやRNA鎖を送達できます。
- リガンドによる担体表面の修飾やアジュバントとの同時送達により、脂質担体は目的の細胞種を標的とすることができます。
脂質の選択はmRNA送達の鍵となる要因であり、構成脂質の組成、サイズ、安定性、帯電、表面への機能付与や、mRNAの内封効率および放出効率を最適化するため、一連のプロセスを経る必要があります。モデルナ社およびファイザー社の脂質ベースのmRNAワクチンの実用化は、COVID-19に対する疫学的戦いにおいて、この技術の重要性を実証しています。
マイクロ流体法による効率的でハイスループットな脂質の最適化
従来、脂質担体はバッチ法(図3B)を用いて、攪拌中の水相に脂質溶液をゆっくり添加することにより生産されてきました。このアプローチは生成するLNPのサイズを十分に制御できず、封入効率が低いものです。また、ラボスケールからパイロットプラントスケール、実生産スケールへと工程をスケールアップするごとに再バリデーションが必要です。マイクロ流体法(図3A)は、これらの点において有用となります。

図3リポソーム作製プロセスの概略図
(A)マイクロ流体法によるリポソームの自己組織化
(B)標準的なバッチ法(エタノール注入法)
mRNAナノ粒子カプセル化におけるマイクロ流体工学の利点
- リードタイムの短縮
- 効率および品質の向上
- 開発コストの削減
- ハイスループット合成に対応
- 自動化が可能であり、製造のスケールアップが容易
マイクロ流体法を用いた合成
マイクロ流体法による合成では、ミキサーチップ内で脂質-有機相とmRNAの水溶液を直接混合すると、RNAが封入された脂質担体が迅速かつ高い再現性で生成します。最近では、自動化されたマイクロ流体ソリューションが開発されています。例えば、Dolomite社のAutomated Nanoparticle System(ANPS)は、様々なプロセス条件下で複数のサンプルを自動合成することにより、生産性を高め、開発のリードタイムを短縮します。最適化された後は連続運転が可能で、in vitroおよびin vivo試験用の材料を大量に製造することができます。
脂質担体の最適化へ向けたNanoFabTx™マイクロ流体キットの導入
NanoFabTx™ナノ製剤デバイスおよび試薬キットは、mRNAワクチン開発における2つの主な課題、すなわち(1)脂質ナノ粒子の選択および最適化、(2)スケーラブルな製造法、に対応しているため、mRNAワクチンの開発に最適です。
NanoFabTx™デバイスおよび試薬キットの利点:
- 長期間の試行錯誤による最適化を必要としない、目的とする製剤のスクリーニングおよび選択のための合理的な手法
- 薬物/RNA送達向けに研究開発された各種脂質製剤のセレクション
- マイクロ流体デバイスキットによる、狭い粒度分布かつ高いバッチ間一貫性を有するmRNA内封リポソームの作製
- 包括的なプロトコール、組立済みのマイクロ流体チップ用マニホールド、Dolomiteマイクロ流体システムやシリンジポンプまたは従来型ナノ沈殿法と互換性のあるアクセサリー
薬物または核酸を内封した脂質またはポリマー担体は、生体適合性および生体分解性を有しています。また、特定の組織を標的とする送達や、緩やかで持続的な薬物放出を実現するため、さらに修飾を施すことができます。
NanoFabTx™マイクロ流体ナノデバイスキットを用いたサイズおよび組成の制御
NanoFabTx™デバイスキットにより、長期間の試行錯誤による最適化を必要とせずに、製剤化のための各種パラメータを評価できます。リポソームのサイズは、流量比(FRR:flow rate ratio)などのパラメータの最適化によって微調整が可能です(図4A)。NanoFabTx™マイクロ流体ナノデバイスキットを使用すれば、製剤や脂質濃度にかかわらず、サイズが一貫したリポソームを合成できます(図4B)。迅速なスクリーニングはワクチン開発早期には必須であり、多くの場合、既存の脂質フィルム水和/押出し法では実現不可能です。
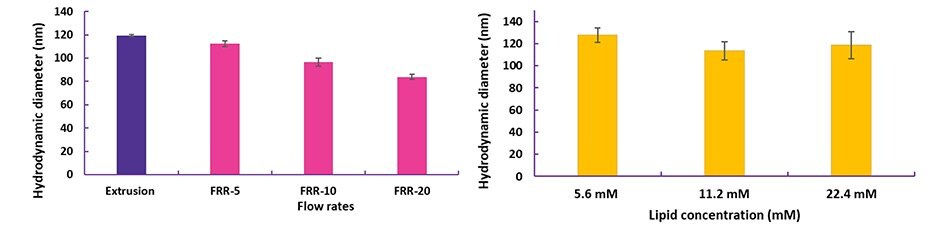
図4 NanoFabTx™マイクロ流体-ナノデバイスキットを用いたリポソーム合成の最適化
(A)低分子を封入したPEG化リポソームを、様々な流量比(FRR、有機相 : 水相)で合成。
(B)siRNAを封入したカチオン性リポソームを、様々な総脂質濃度で合成。リポソームのサイズは、動的光散乱(DLS:dynamic light scattering)法を用いて測定。
NanoFabTx™試薬およびデバイスキットを用いて調製したsiRNA内包リポソームの細胞内送達
NanoFabTx™試薬およびデバイスキットを用いて作製したsiRNA内包リポソームの送達および取り込みを、複数の例で評価しました。最初に、蛍光標識FAMsiRNAを内封したカチオン性リポソームがA549肺癌細胞に取り込まれることが、in vitroで確認されました(図5)。FAMsiRNA単体(nakedのFAMsiRNA)の取り込みは観察されません。これに対し、FAMsiRNA内包リポソーム(Lipo-FAMsiRNA)を細胞に添加したところ、90%を超える細胞が強い蛍光シグナルを発し、カチオン性リポソームと複合体を形成したFAMsiRNAが確実に取り込まれることが示唆されました。
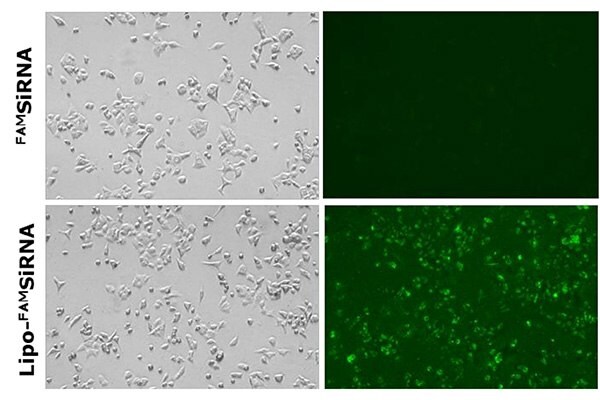
図5nakedのFAMsiRNA(上段)およびFAMsiRNAとカチオン性リポソームの複合体(下段)の肺癌細胞株A549への送達。画像はすべて蛍光顕微鏡を用いて撮影。
siRNAのGFP標識HeLa細胞への送達および同細胞のサイレンシングもin vitroで評価しました。NanoFabTx™試薬およびデバイスキットを用いて、様々なN/P比(DOTAPの窒素[N]/ siRNAのリン[P]の比)のリポソームを調製し、最適な導入効率のリポソームをスクリーニングしました。N/P比が7.5と5の条件での導入効率は同程度であり、未処理の対照細胞と比較してGFP発現レベルが約40%減少しました。さらに、siRNAによるGFPのノックダウン効率を最適化するため、3種類の配列のsiRNAをスクリーニングしました。2種類の配列(siGFP-126およびsiGFP-240)は、GFP-HeLa細胞に40~50%のサイレンシング(GFP発現レベルの減少)を誘導しました(図6Cおよび図6D)。これらの結果から、NanoFabTx™プラットフォームにより調製されたリポソームは、siRNAをGFP-HeLa細胞内に送達するのみならず、標的遺伝子に対するサイレンシング効果も示すことが示唆されました。さらに、リポソームの調製方法(マイクロ流体法 vs. 押出し法)を直接比較したところ、導入効率は同程度であることが示されましたが、多大な労力を要する押出し法と比較して、マイクロ流体法による調製がより容易であることが示されました。
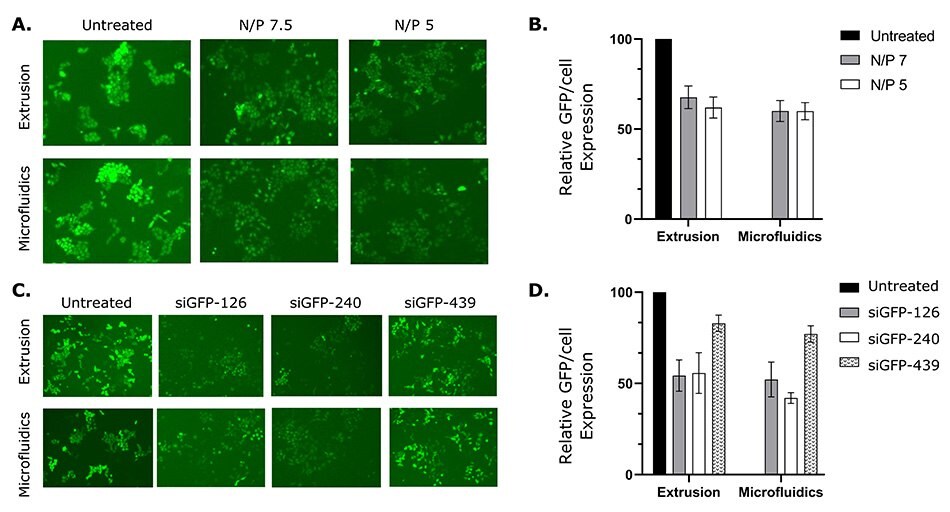
図6NanoFabTx™試薬およびデバイスキットを用いて調製されたsiRNA内包リポソームによるGFP-HeLa細胞のGFP発現のサイレンシング。様々なN/P比のリポソーム-siRNAを添加したGFP-HeLa細胞の(A)代表的な蛍光画像。(B)1細胞あたりのGFP相対発現量(未処理の対照細胞と比較した1細胞あたりの発現量の相対値)。様々なsiRNA配列を用いたリポソーム-siRNA複合体を添加したGFP-HeLa細胞の(C)代表的な蛍光画像。(D)1細胞あたりのGFP相対発現量。
NanoFabTx™のワクチン開発への応用
以上の結果は、RNAおよび他の治療薬の送達を目的とする各種リポソーム合成におけるNanoFabTx™試薬およびデバイスキットの性能を示しています。NanoFabTx™プラットフォームは柔軟性に優れており、所望のリポソームサイズ、薬物内包および標的送達が実現するように、配合や流量比といったパラメータをスクリーニングし、最適化することができます。Sigma-AldrichとDolomiteは、NanoFabTx™デバイスキットと最適化されたプロトコールを用いたリポソーム合成のマイクロ流体ソリューションを共同で開発しました。これらのキットにより、十分に制御されたマイクロ・ナノ粒子の迅速な合成が可能となり、mRNA治療薬やワクチンなどの開発に適用できるほか、Dolomite社のAutomated Nanoparticle System(ANPS)を用いて、非臨床評価用にスケールアップできます。NanoFabTx™キットと共にANPSを使用すれば、リポソーム、脂質ナノ粒子やその他の高分子ナノ粒子の少量サンプルの作製を自動化し、ワクチン開発の鍵となる以下の課題に対処することができます。
- プラスミド作製に用いる細菌株の指向性進化
- ワクチン生産に最適な酵母/細菌株の指向性進化
- 抗体スクリーニング
- アジュバント製剤の開発・生産
- ワクチン送達粒子の開発・生産
NanoFabTx™試薬キット
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?