はじめに
酸化鉄を内包した共役発光ポリマーナノ粒子(単に共役ポリマーナノ粒子(CPN:Conjugated Polymer Nanoparticle)とも呼ばれます)は、生体適合性界面活性剤内にカプセル化された半導体発光ポリマー(LEP:light emitting polymer)コアで構成される高い蛍光性を有するナノ粒子です。この革新的な分子バイオイメージングプローブは、他の標識剤を大幅に上回る蛍光特性を備えています。その非常に高い輝度は、並外れた消衰係数と優れた光、熱、化学的安定性によって得られます1。さらに、CPNは毒性を示さないため、生細胞システムに容易に適合します2,3。また、CPNコアには酸化鉄成分が含まれているため、磁気操作に適しており、理想的なマルチモーダルMRIイメージング剤となっています。表1に、CPNの特性を示しました。
CPNは、可視スペクトルの420~680 nmまでの蛍光発光波長をカバーしています。そのため、標準的なフィルターセットやレーザーラインに適合する範囲で、フローサイトメトリー、免疫組織化学、ELISA、ラテラルフローデバイスなど、CPNは多くの用途で利用可能です。これらは表面のカルボキシル基によって可能になり、抗体、タンパク質、ストレプトアビジン、核酸を含む幅広い分子とコンジュゲーションすることができます(図1)。
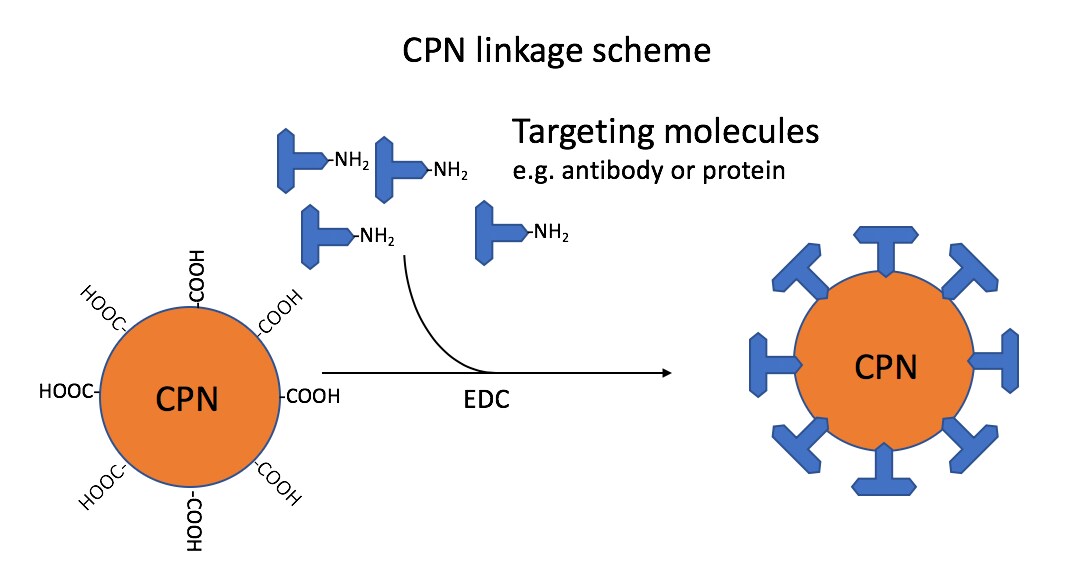
図1CPNの結合スキーム:カルボキシル基を介して抗体などの標的分子のアミノ基と結合したCPN。この反応は、カルボジイミド架橋剤(EDC:1-ethyl-3-(3-dimethylaminopropyl)carbodiimide)を用いて行われます。標準的なプロトコルでは、各CPNに対して約40の比率でIgG抗体を結合させます。
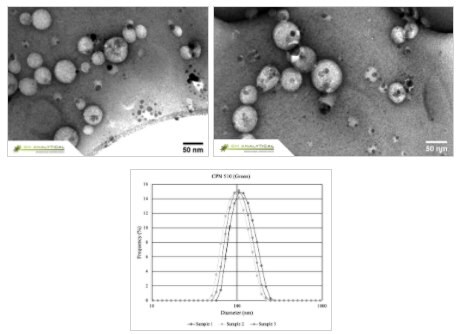
図2CPNは、透過型電子顕微鏡(TEM、上図)、動的光散乱法(DLS、下図)に示すように、サイズと形状において優れた均一性を示します。
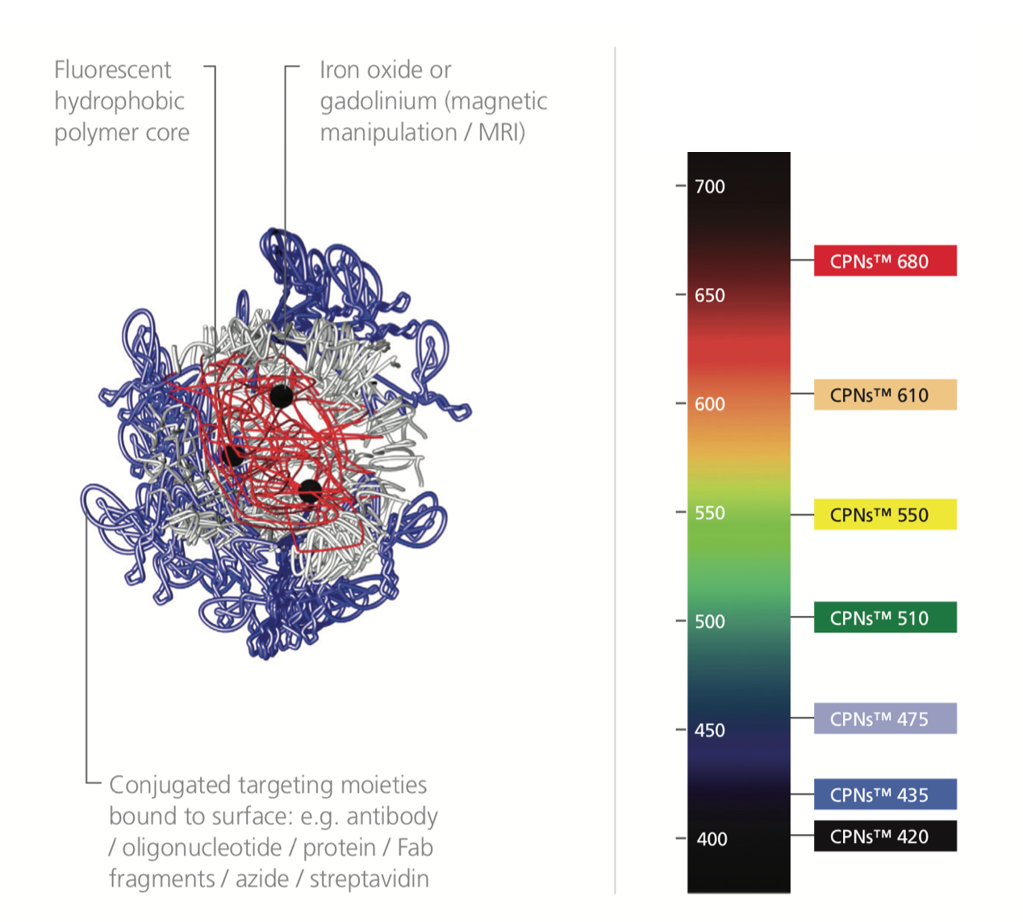
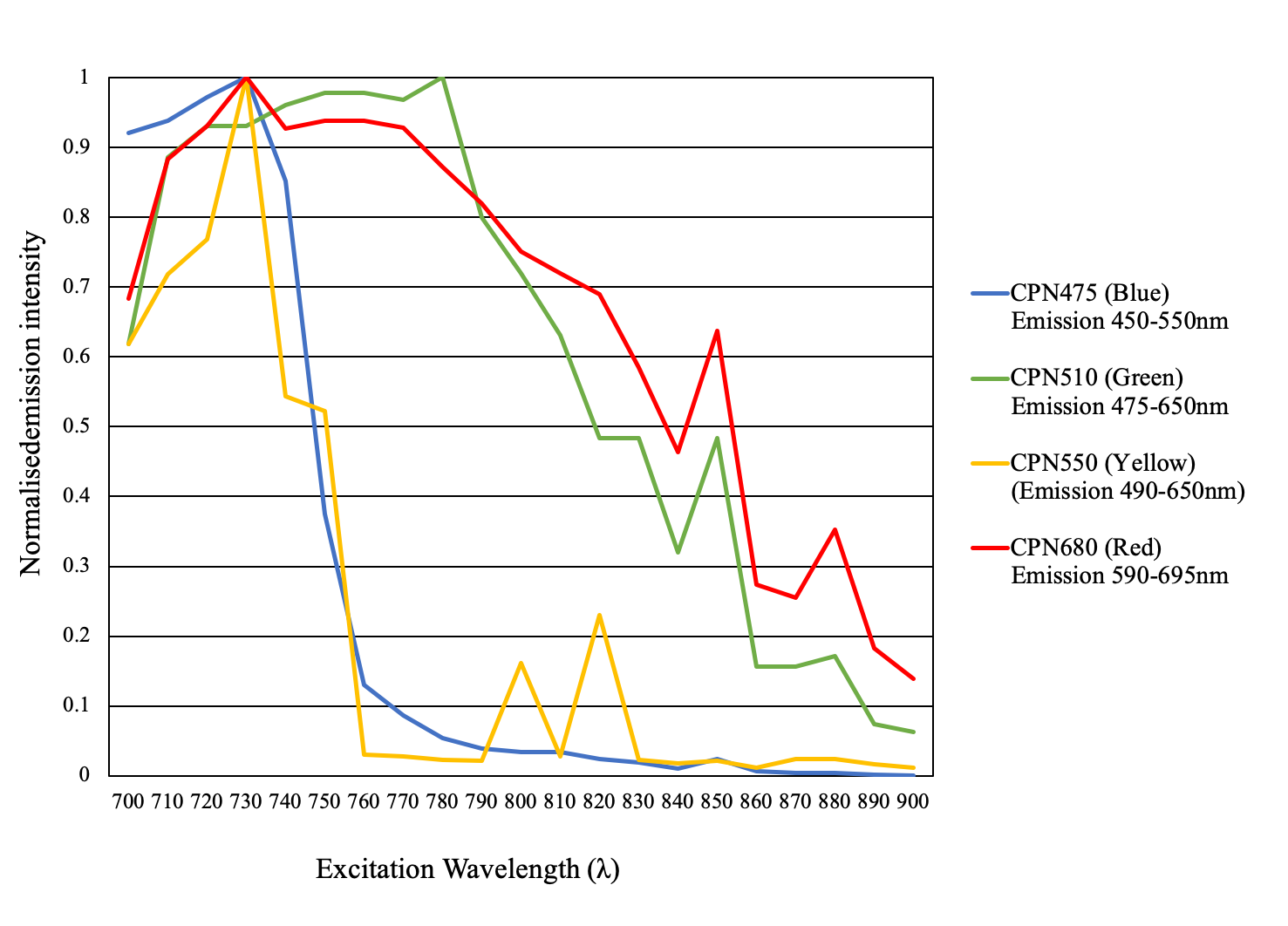
図3CPNの構造および利用可能なCPNの波長を示した光スペクトル。CPNは、多くの有機色素よりも大きなストークスシフトで吸収します。
コア内に酸化鉄を組み込むことで、結合した分子や細胞を磁気を利用して操作することができ(図4)、ターゲットの濃縮と精製が容易になります。その酸化鉄成分により、CPNはマルチモーダルイメージングが可能なイメージング剤となります。これは、蛍光とMRI(Magnetic Resonance Imaging、磁気共鳴画像)の両方を使用してイメージングできるためです2,15。磁気特性は、結合アッセイおよびプレートベースアッセイでも利用でき、シグナル強度の向上と検出範囲の拡大により、低濃度のバイオマーカーを検出する際の感度を向上させることができます。
A)

B)
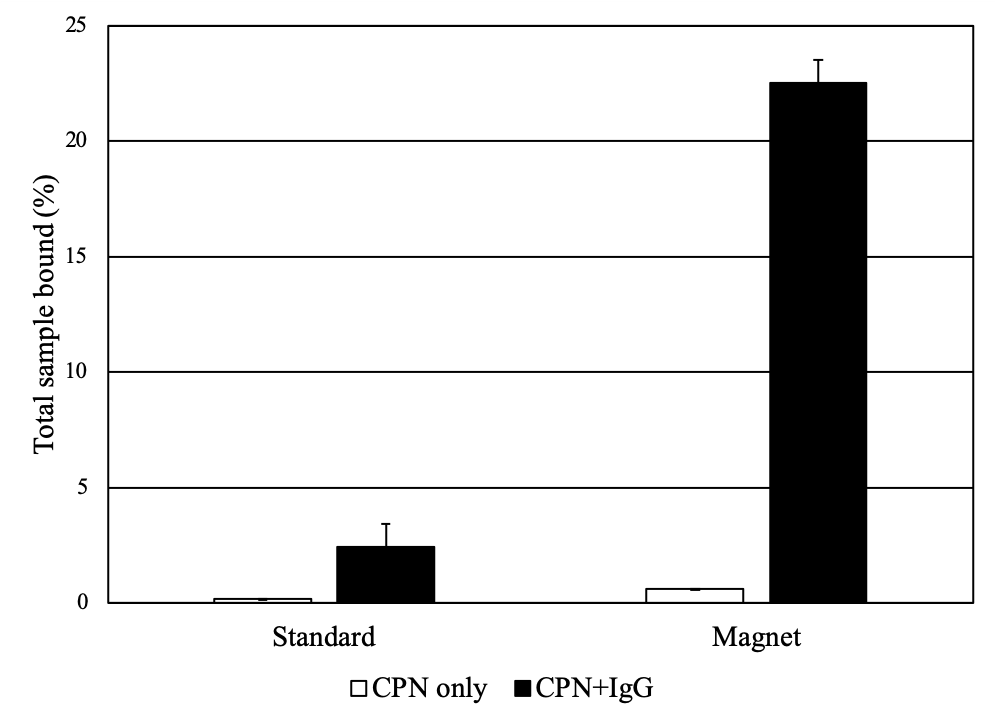
図4A)UV照射および磁場下でのCPN溶液。磁性と蛍光のデュアルモダリティが可能であることを示しています。(Howesらの論文2から編集および転載)B)CPNは、プレートベースのIgG結合アッセイにおける結合の傾向を高めます。IgGに非結合または結合したCPNを、プロテインA/Gでコーティングしたプレート上でインキュベートして、結合イベントを測定しました。IgGと結合したCPNは、磁石を用いると、プレート底部に向かって引き下げられ、ターゲット部位で局所的に濃度が増加するため、はるかに強力なアッセイ信号を示します。
光学特性
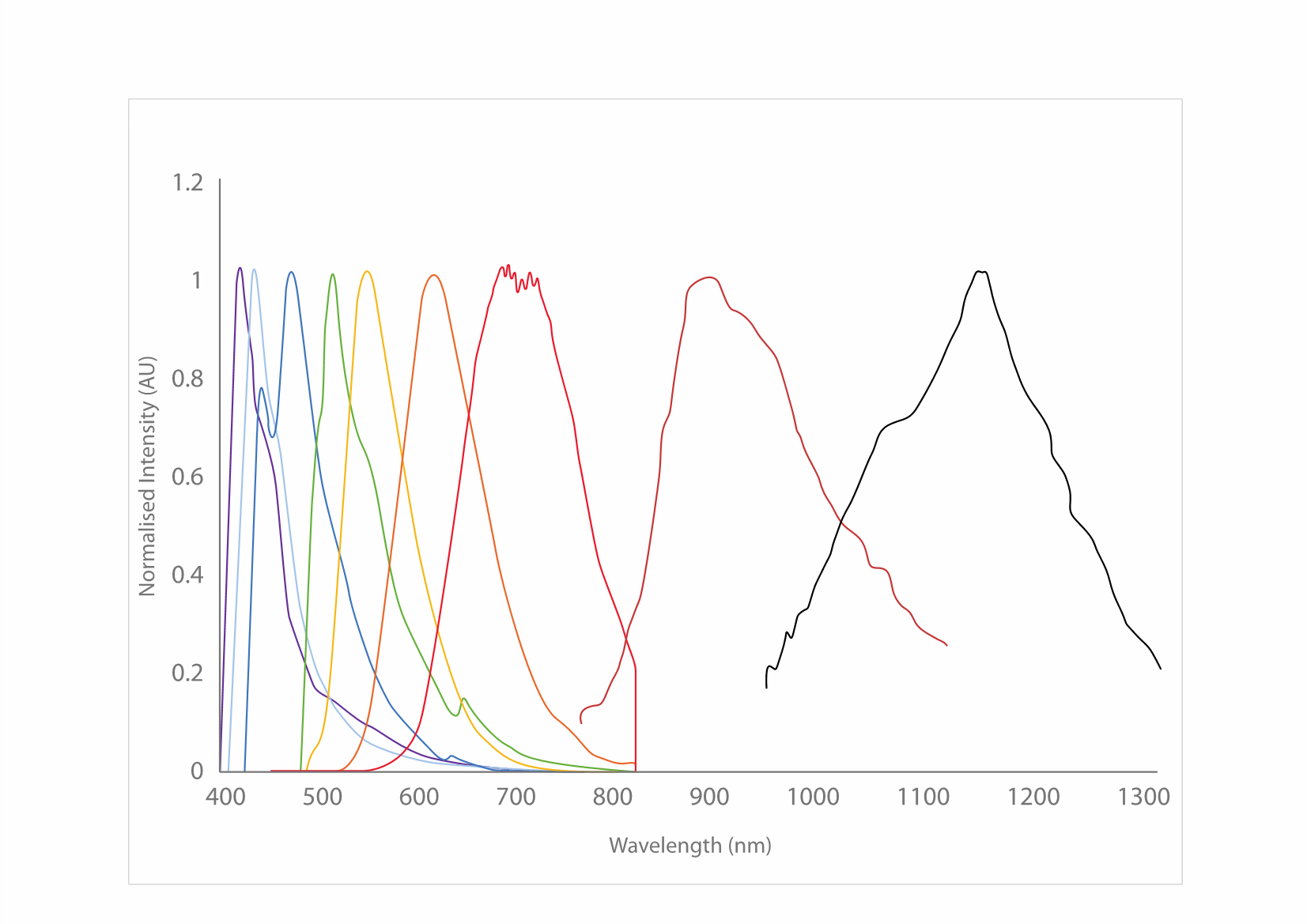
その強い輝度と高度な光安定性により、CPNは様々な画像技術と診断技術を向上させることができます。CPNの発光色は、特定のポリマーコアに依存し、さまざまな蛍光放出波長の製品が提供されており、可視域にて7つの発光波長が利用可能です。420 nm、435 nm、475 nm、510 nm、550 nm、610 nm、680 nmにおいて離散的な発光ピークを示し、また、900 nmおよび1130 nmの近赤外域の発光ピークを示す製品も提供しています(図5)。共役ポリマーナノ粒子は、量子ドットよりも175倍明るく、細胞内ではAF488-dexよりも1400倍明るいことが報告されています3,14。
A)
B)
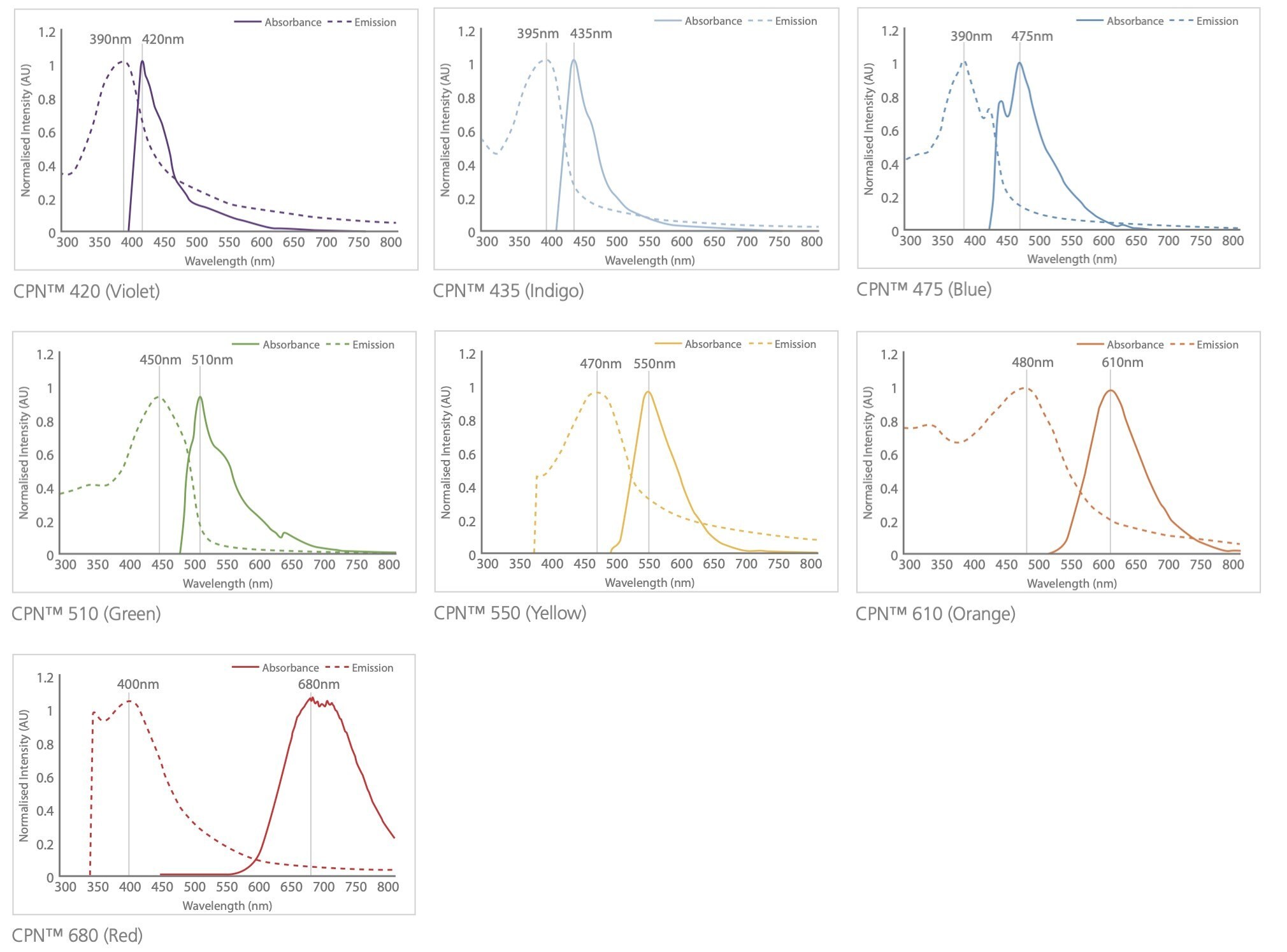
図5可視および近赤外スペクトル域をカバーするCPNの励起および発光スペクトル
結合および非結合型の両方で、CPNは周囲温度と照明条件下で保存された場合でも、蛍光特性を最大24か月間保持します(図6)。

図6CPNは最長24か月間光安定性を維持し、長期保管でもその優れた蛍光性を保持します。
生体機能化
CPNは、エンドサイトーシスを介して、またはストレプトアビジン、抗体、受容体リガンドタンパク質などの特定の標的部位との結合によって標的細胞を標識することができるため、幅広い結合および標的化アプリケーションに適しています。
CPNの標的部位へのカップリングにはEDC化学が用いられ、タンパク質のアミノ基(-NH2)をCPN表面のカルボキシル基(-COOH)に結合させます。クリックケミストリーのためのチオールやアジドなど、その他の表面グループも利用できます。CPNの輝度により、フローサイトメトリーや免疫細胞/組織化学における単一分子の検出が可能となり、検出感度が高くなります16。そのため、サンプルおよび細胞内の個々のタンパク質の研究が可能になります。
アプリケーションの多様性
CPNの優れた蛍光性、安定性、マルチモダリティは、下記のような多くのライフサイエンス用途で高い機能性と適用性を可能にし、様々な手法を強化することができます(図7)。また、CPNの共役ポリマーコアは、ユニークな光学特性を提供します。この特性と、その輝度や光安定性とが相まって、CPNは二光子/多光子顕微鏡などのアプリケーションで特に有用であり、その適合性が実験的に検証されています(図8)
- 蛍光顕微鏡(ハイコンテントスクリーニング、ライブセルトラッキング、3D細胞イメージング)9,16
- 免疫組織化学および免疫細胞化学16
- フローサイトメトリー5,9,17
- 迅速診断検査(RDT:rapid diagnostic test)12,13
- 組織イメージング6–8
- 2光子イメージング
- 近赤外イメージング10,11,15
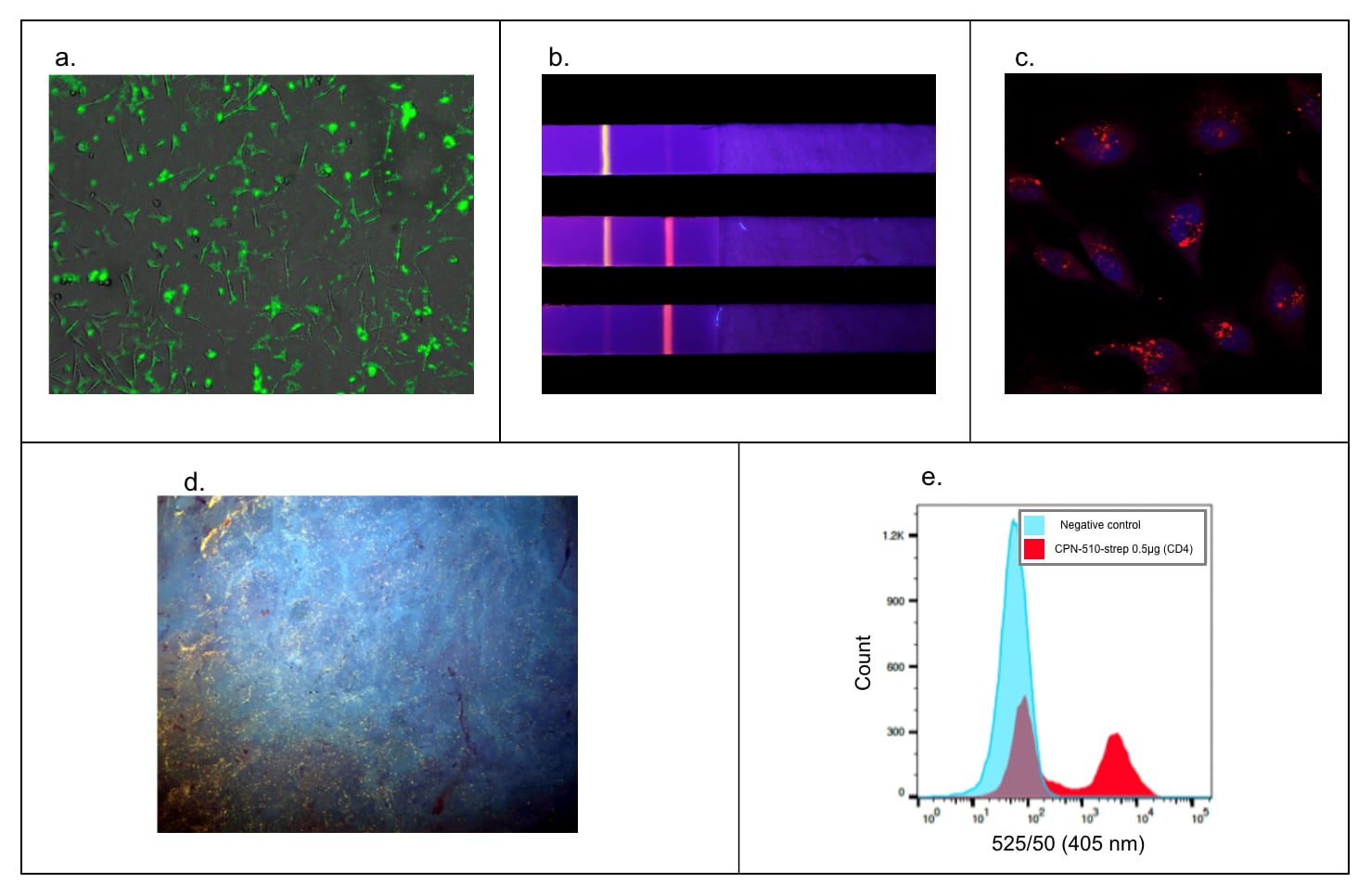
図7幅広いアプリケーションにおけるCPNの多様性。A)蛍光顕微鏡。905038で標識されたHEK293T細胞膜9。B)CPNを用いた迅速診断テストストリップによる迅速診断検査。1つのストリップで複数の粒子を同時に使用して、複数の診断を行うことができます12,13。C)Z-Stack顕微鏡。904996(赤)と核染色(DAPI、青)で染色されたHeLa細胞9。D)UV surface excitation optical section imaging systemを用いた顕微鏡による組織染色。パラフィン包埋組織中の構造は、905038(黄色)を用いて標識することができます。E)フローサイトメトリー5,9,17。CD-4陽性細胞の50%分集団の標識を示す905038。
.
まとめ
CPNには、分子や細胞の蛍光標識への応用において、大きな可能性があります。その高い輝度は、低レベルのタンパク質や希少な細胞タイプの検出とイメージングを可能にするだけでなく、繊細な細胞や組織に対しては低レベルの励起での使用が可能になることも意味します3。CPNの堅牢性により、必要に応じて高輝度照明下や極端な実験条件での使用が可能であり、また、24か月の長期保管や常温での保管にも対応しています。さらに、最高120℃までの温度と2~10のpHに耐えることができます。独自の輝度、優れた安定性、磁性、幅広い分子と結合できる適合性により、CPNはライフサイエンスの幅広いアプリケーションに多くの機能強化と利点を提供します。
References
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?