F3879
Fibrinogeno
50-70% protein (≥80% of protein is clottable)
Sinonimo/i:
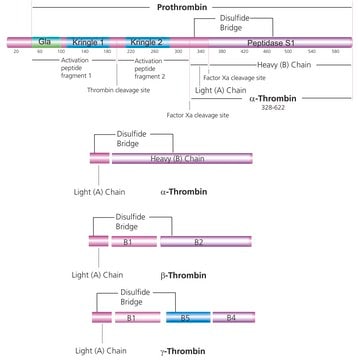
Fattore I
About This Item
Prodotti consigliati
Origine biologica
human plasma
Livello qualitativo
Forma fisica
powder
Qualità
50-70% protein (≥80% of protein is clottable)
PM
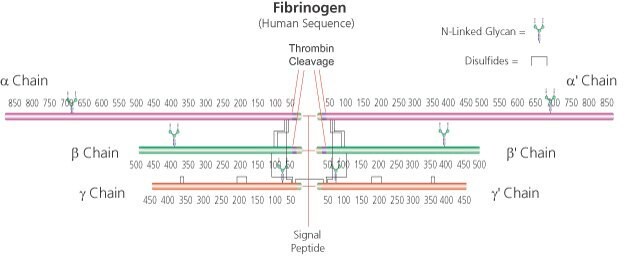
α-chain 63.5 kDa
β-chain 56 kDa
γ chain 47 kDa (about 4% carbohydrate content)
soluble dimer 340 kDa
Concentrazione
50-70% protein (biuret)
tecniche
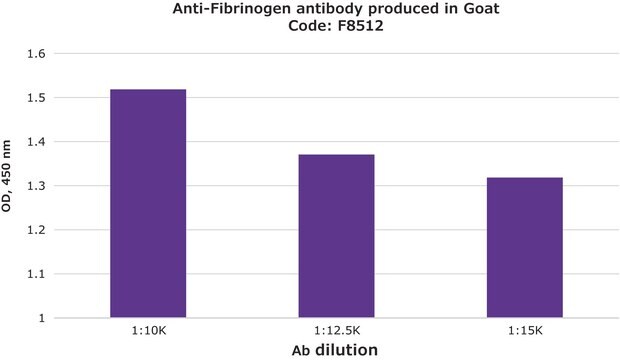
ELISA: suitable
Solubilità
0.9% NaCl: soluble 10 mg/mL
Temperatura di conservazione
−20°C
Cerchi prodotti simili? Visita Guida al confronto tra prodotti
Descrizione generale
Applicazioni
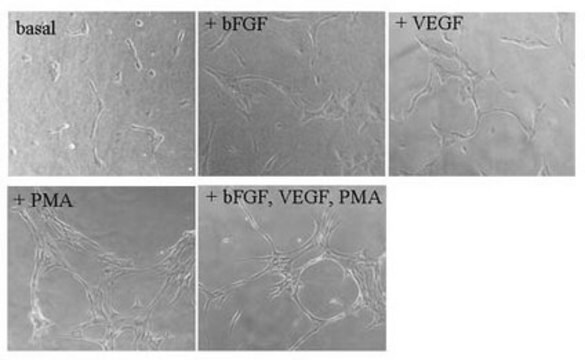
Il fibrinogeno è stato usato anche nello sviluppo di un saggio di microarray del saggio immuno-assorbente legato a un enzima a sandwich specifico per il fibrinogeno per distinguere i campioni di plasma dai campioni di siero.
Il fibrinogeno da plasma umano è stato usato:
- per la produzione di idrogel di fibrina
- per la preparazione di strutture di fibrina-cellule staminali mesenchimali (MSC)-cartilagine
- per analizzare le proprietà repellenti nei confronti delle proteine della superficie di PFDA-co-DEGDME (dietilenglicole dimetiletere) con microbilancia ai cristalli di quarzo (QCM).
Azioni biochim/fisiol
Specifiche
Stato fisico
Ricostituzione
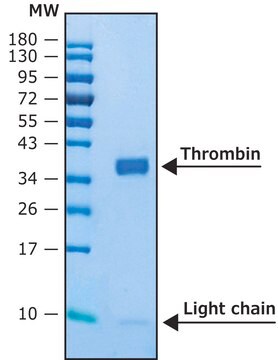
Risultati analitici
Esclusione di responsabilità
Codice della classe di stoccaggio
11 - Combustible Solids
Classe di pericolosità dell'acqua (WGK)
WGK 3
Punto d’infiammabilità (°F)
Not applicable
Punto d’infiammabilità (°C)
Not applicable
Dispositivi di protezione individuale
Eyeshields, Gloves, type N95 (US)
Certificati d'analisi (COA)
Cerca il Certificati d'analisi (COA) digitando il numero di lotto/batch corrispondente. I numeri di lotto o di batch sono stampati sull'etichetta dei prodotti dopo la parola ‘Lotto’ o ‘Batch’.
Possiedi già questo prodotto?
I documenti relativi ai prodotti acquistati recentemente sono disponibili nell’Archivio dei documenti.
I clienti hanno visto anche
Articoli
We will explore the technological advances that have contributed toward the progress of 3DP of tissue engineering scaffolds, current materials used to create 3DP scaffolds, and the challenges that remain.
Il team dei nostri ricercatori vanta grande esperienza in tutte le aree della ricerca quali Life Science, scienza dei materiali, sintesi chimica, cromatografia, discipline analitiche, ecc..
Contatta l'Assistenza Tecnica.