MABS1254
Anticorpo anti-O-GlcNAc, clone CTD110.6
clone CTD110.6, from mouse
Sinonimo/i:
O-GlcNAc, beta-O-GlcNAc, O-Linked N-Acetylglucosamine, beta-O-linked N-acetylglucosamine
About This Item
Prodotti consigliati
Origine biologica
mouse
Livello qualitativo
Forma dell’anticorpo
purified immunoglobulin
Tipo di anticorpo
primary antibodies
Clone
CTD110.6, monoclonal
Reattività contro le specie (prevista in base all’omologia)
all
tecniche
ELISA: suitable
immunoprecipitation (IP): suitable
western blot: suitable
Isotipo
IgMκ
modifica post-traduzionali bersaglio
glycosylation
Informazioni sul gene
human ... OGT(8473)
Descrizione generale
Specificità
Immunogeno
Applicazioni
Trasduzione del segnale
Modificazioni post-traduzionali generali
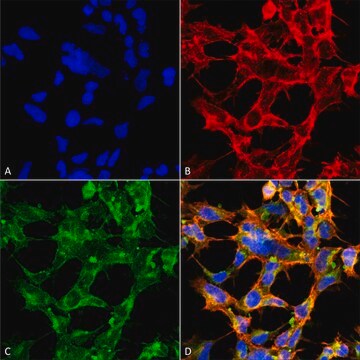
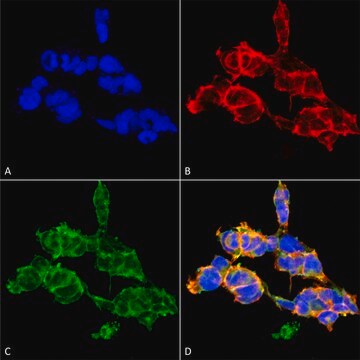
Saggio ELISA: con un lotto rappresentativo è stato rivelato il peptide (YSPTSPS) del dominio C-terminale (CTD) della RNA polimerasi II che presenta una singola serina o treonina O-GlcNAcilata ma non il corrispondente peptide non modificato (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169-177.)
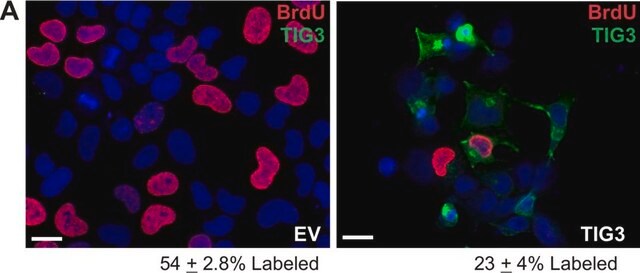
Immunoprecipitazione: un lotto rappresentativo ha determinato l'immunoprecipitazione delle proteine O-GlcNAcilate da cellule staminali totipotenti umane (hPSC) (Maury, J.J., et al. (2013). Stem Cell Res. 11(2):926-937.)
Immunoprecipitazione: un lotto rappresentativo ha determinato l'immunoprecipitazione delle proteine O-GlcNAcilate da estratti di cellule HeLa (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169-177).
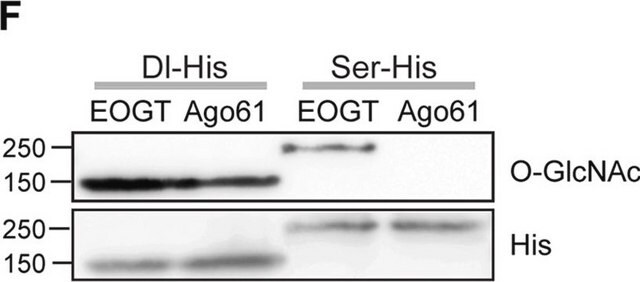
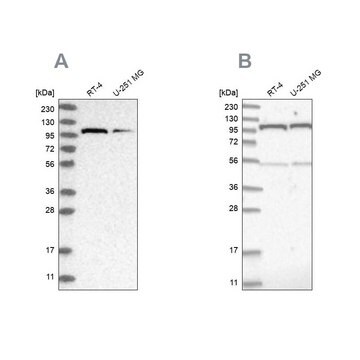
Saggio di Western blotting: un lotto rappresentativo ha permesso di rivelare livelli paragonabili di O-GlcNAcilazione in cellule staminali totipotenti umane (hPSC) indifferenziate, in fase di differenziamento e differenziate in modo terminale (Maury, J.J., et al. (2013). Stem Cell Res. 11(2):926-937).
Saggio di Western blotting: con un lotto rappresentativo è stato rivelato il peptide (YSPTSPS) del dominio C-terminale (CTD) della RNA polimerasi II BSA-coniugato e con beta-O-GlcNAc ma non con alfa-O-GlcNAc né con il corrispondente peptide non modificato. La presenza di GlcNAc, ma non quella di GalNAc, ha impedito la rivelazione delle bande di interesse (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169-177).
Saggio di Western blotting: un lotto rappresentativo ha permesso di rivelare le proteine O-GlcNAcilate nell'estratto nucleare di cellule HeLa e le proteine O-GlcNAcilate nell'estratto nucleare e citosolico di cellule HeLa purificate mediante colonna di agglutinina di germe di grano (WGA). Bloccando gli anticorpi con il peptide immunogeno prima dell'immunoblotting non è stato possibile rivelare le bande di interesse (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169-177).
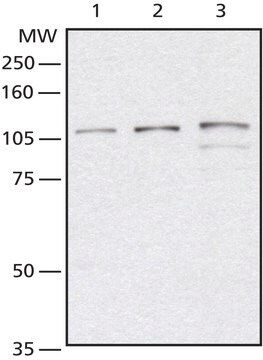
Saggio di Western blotting: un lotto rappresentativo ha permesso di rivelare la modulazione positiva (up-regulation) delle proteine O-GlcNAcilate in cellule Jurkat trattate con PUGNAc, un inibitore della glucosamminidasi, e con glucosammina, il prodotto intermedio della via dell'esosammina (Comer, F.I., et al. (2001). Anal. Biochem. 293(2): 169-177).
Qualità
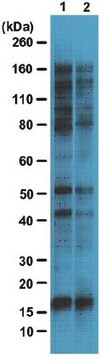
Saggio di Western blotting: questo anticorpo alla concentrazione di 4,0 µg/mL ha permesso di rivelare le proteine O-GlcNAcilate in 10 µg di lisato di cellule HeLa.
Descrizione del bersaglio
Stato fisico
Stoccaggio e stabilità
Altre note
Esclusione di responsabilità
Non trovi il prodotto giusto?
Prova il nostro Motore di ricerca dei prodotti.
Codice della classe di stoccaggio
10 - Combustible liquids
Classe di pericolosità dell'acqua (WGK)
WGK 2
Punto d’infiammabilità (°F)
Not applicable
Punto d’infiammabilità (°C)
Not applicable
Certificati d'analisi (COA)
Cerca il Certificati d'analisi (COA) digitando il numero di lotto/batch corrispondente. I numeri di lotto o di batch sono stampati sull'etichetta dei prodotti dopo la parola ‘Lotto’ o ‘Batch’.
Possiedi già questo prodotto?
I documenti relativi ai prodotti acquistati recentemente sono disponibili nell’Archivio dei documenti.
Il team dei nostri ricercatori vanta grande esperienza in tutte le aree della ricerca quali Life Science, scienza dei materiali, sintesi chimica, cromatografia, discipline analitiche, ecc..
Contatta l'Assistenza Tecnica.