Alle Fotos(6)
Wichtige Dokumente
T9201
Trypsin aus Rinderpankreas
powder, ≥7,500 BAEE units/mg solid
Synonym(e):
Serine Protease 1
Anmeldenzur Ansicht organisationsspezifischer und vertraglich vereinbarter Preise
Alle Fotos(6)
About This Item
Empfohlene Produkte
Form
powder
Qualitätsniveau
Spezifische Aktivität
≥7,500 BAEE units/mg solid
Mol-Gew.
23.8 kDa
Zusammensetzung
, ≥90 % protein
Verunreinigungen
≤3 BTEE units/mg solid Chymotrypsin
Lagertemp.
−20°C
Suchen Sie nach ähnlichen Produkten? Aufrufen Leitfaden zum Produktvergleich
Verwandte Kategorien
Anwendung
Für den Trypsinverdau von Peptiden ein Verhältnis von ca. 1:100 bis 1:20 (Trypsin:Peptid) verwenden. Die typische Verwendung für dieses Produkt besteht im Entfernen von adhärenten Zellen von einer Kulturoberfläche. Die zum Ablösen von Zellen von ihrem Substrat erforderliche Trypsinkonzentration hängt in erster Linie vom Zelltyp und dem Alter der Kultur ab. Trypsine werden auch für die Resuspendierung von Zellen während der Zellkultur, in der Proteomikforschung für den Verdau von Proteinen und in verschiedenen In-Gel-Verdaus verwendet. Weitere Anwendungsbereiche sind u. a. die Beurteilung der Kristallisierung mit membranbasierten Methoden und eine Studie zur Feststellung, ob Proteinfaltungsraten und Proteinausbeuten durch das Vorhandensein von sog. „kinetischen Fallen“ begrenzt werden können.
Biochem./physiol. Wirkung
Trypsin spaltet Peptide auf der C-terminalen Seite von Lysin- und Argininrückständen. Die Hydrolyse dieser Reaktion wird verlangsamt, wenn sich auf einer der Seiten der Spaltstelle ein Säurerest befindet, und die Hydrolyse wird beendet, wenn sich auf der Carboxylseite der Spaltstelle ein Prolinrest befindet. Der optimale pH-Wert für die Trypsinaktivität liegt zwischen 7 und 9. Trypsin kann auch zum Spalten von Ester und Amidbindungen von synthetischen Derivaten von Aminosäuren eingesetzt werden. EDTA wird Trypsinlösungen als Chelatbildner zugegeben, der Calcium- und Magnesiumionen neutralisiert, welche die Peptidbindungen verdecken, auf die sich das Trypsin auswirkt. Durch das Entfernen dieser Ionen wird die enzymatische Aktivität verstärkt.
Serinprotease-Inhibitoren, u. a. DFP, TLCK, APMSF, AEBSEF und Aprotinin, hemmen Trypsin.
Serinprotease-Inhibitoren, u. a. DFP, TLCK, APMSF, AEBSEF und Aprotinin, hemmen Trypsin.
Komponenten
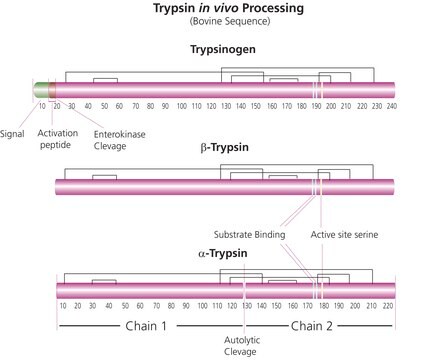
Trypsin besteht aus einem einsträngigen Polypeptid aus 223 Aminosäureresten und wird durch Entfernung des N-terminalen Hexapeptids von Trypsinogen produziert, das an der Lys-Ile-Peptidbindung abgespalten wird. Die Aminsäuresequenz ist durch 6 Disulfidbrücken quervernetzt. Dies ist die native Form von Trypsin, Beta-Trypsin. Beta-Trypsin kann durch Autolyse am Lys-Ser-Rest aufgespalten und so in Alpha-Trypsin umgewandelt werden. Trypsin gehört zur Familie der Serinproteasen.
Vorsicht
Lösungen in 1 mM HCl sind in Aliquoten bei einer Temperatur von -20 °C gelagert 1 Jahr haltbar. Das vorhandene Ca2+ reduziert zudem die Autolyse von Trypsin und erhält dessen Stabilität in Lösung. Trypsin behält auch den Großteil seiner Aktivität in 2,0 M Harnstoff, 2,0 M Guanidin HCl oder 0,1 % (w/v) SDS bei.
Einheitendefinition
Eine BAEE-Einheit erzeugt unter Verwendung von BAEE als Substrat ein A253 von 0,001 pro Minute bei einem pH-Wert von 7,6 und einer Temperatur von 25 °C.
Angaben zur Herstellung
Dieses Produkt stammt aus dem Pankreas und wird aus Neuseeland bezogen. Es ist in 1 mM HCl bei 1 mg/mL löslich.
Ersetzt durch
Produkt-Nr.
Beschreibung
Preisangaben
Signalwort
Danger
H-Sätze
Gefahreneinstufungen
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
Zielorgane
Respiratory system
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 1
Persönliche Schutzausrüstung
dust mask type N95 (US), Eyeshields, Faceshields, Gloves
Hier finden Sie alle aktuellen Versionen:
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Vandana Shashi et al.
Human mutation, 40(8), 1115-1126 (2019-07-03)
Encoding the slow skeletal muscle isoform of myosin binding protein-C, MYBPC1 is associated with autosomal dominant and recessive forms of arthrogryposis. The authors describe a novel association for MYBPC1 in four patients from three independent families with skeletal muscle weakness
Rasmus Karstad et al.
Journal of medicinal chemistry, 55(14), 6294-6305 (2012-06-23)
This study investigates how the S1 and S3 site of trypsin can be challenged with cationic amino acid analogues to yield active antimicrobial peptides with stability toward tryptic degradation. It is shown that unnatural analogues can be incorporated to generate
Claire E J Waterborg et al.
PloS one, 13(10), e0205902-e0205902 (2018-10-20)
Rheumatoid arthritis is an auto-immune disease of the synovial joints, hallmarked by chronic inflammation and subsequent progressive tissue destruction. TYRO3, AXL and MER (gene name Mertk) (TAM) receptors are part of a negative feedback signaling system in the immune reaction
Christo Nanev et al.
IUCrJ, 8(Pt 2), 270-280 (2021-03-13)
The nucleation ability of pores is explained using the equilibration between the cohesive energy maintaining the integrity of a crystalline cluster and the destructive energy tending to tear it up. It is shown that to get 3D crystals it is
Rachel Freire et al.
Scientific reports, 9(1), 7029-7029 (2019-05-09)
Celiac disease (CD) is an immune-mediated disorder triggered by gluten exposure. The contribution of the adaptive immune response to CD pathogenesis has been extensively studied, but the absence of valid experimental models has hampered our understanding of the early steps
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.