A6007
Apotryptophanase from Escherichia coli
soluble powder, 75-150 units/mg solid
Sinônimo(s):
Tryptophanase from Escherichia coli, L-Tryptophan indole-lyase (deaminating)
About This Item
Produtos recomendados
fonte biológica
Escherichia coli
Nível de qualidade
Formulário
soluble powder
atividade específica
75-150 units/mg solid
temperatura de armazenamento
−20°C
Procurando produtos similares? Visita Guia de comparação de produtos
Aplicação
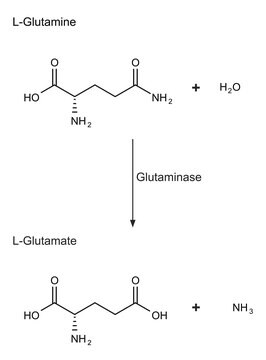
Ações bioquímicas/fisiológicas
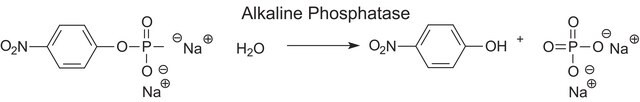
Definição da unidade
Código de classe de armazenamento
11 - Combustible Solids
Classe de risco de água (WGK)
WGK 3
Ponto de fulgor (°F)
Not applicable
Ponto de fulgor (°C)
Not applicable
Equipamento de proteção individual
Eyeshields, Gloves, type N95 (US)
Escolha uma das versões mais recentes:
Certificados de análise (COA)
Não está vendo a versão correta?
Se precisar de uma versão específica, você pode procurar um certificado específico pelo número do lote ou da remessa.
Já possui este produto?
Encontre a documentação dos produtos que você adquiriu recentemente na biblioteca de documentos.
Nossa equipe de cientistas tem experiência em todas as áreas de pesquisa, incluindo Life Sciences, ciência de materiais, síntese química, cromatografia, química analítica e muitas outras.
Entre em contato com a assistência técnica