病毒载体疫苗生产
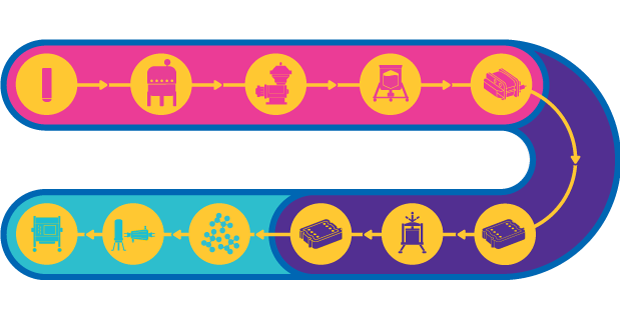
图1.病毒载体疫苗的工艺链
活载体疫苗使用减毒或无害的微生物(例如腺病毒)来运输抗原的一部分以刺激免疫反应。载体疫苗能够诱导有效的细胞介导免疫,这对于艾滋病、疟疾和癌症等复杂疾病至关重要。
虽然疫苗载体的生产工艺非常模式化,但可能会存在一些挑战,因为可使用具有不同特性的多种不同病毒。对于大型病毒载体,由于存在与无菌过滤相关的产量损失,因此工艺的无菌性至关重要。在载体聚集和和稳定性方面也存在挑战。
此外,多个I/II期工艺涉及到贴壁细胞培养;因此,扩大化到III期和商品化生产可能需要对工艺进行调整以实现生产目标。在后期阶段,产品产量和纯度至关重要,因为最终的产品需要高剂量的滴度。
相关资源
加快走向临床并确保可靠扩大化
为了满足生产力要求,必须对针对生产病毒载体疫苗而开发的上游培养工艺进行优化。该优化包括细胞裂解和澄清步骤,这对于去除细胞和细胞碎片并确保稳定的载体收集至关重要。然而,只有能够针对预期市场需求进行可靠扩大化的上游工艺才能成功。
通过稳健地去除杂质实现产量和效率目标
来自裂解细胞的核酸是病毒载体疫苗工艺中的一种常见污染物。监管规定要求残留的宿主细胞核酸水平需低于10 ng/减毒病毒疫苗剂量。Benzonase®核酸内切酶处理以及随后的切向流过滤是一种稳健而强大的组合,可降解和去除残留的核酸成分。
最大限度提高下游回收率
小规模的临床批次通常使用基于CsCl的密度梯度超速离心进行纯化,而大规模生产则需要两步或三步的层析过程。阴离子交换通常用于去除HCP、DNA、RNA和其他主要污染物,而尺寸排阻色谱可用于痕量污染物的去除。
确保患者安全
无菌过滤可确保最终制剂产品的无菌性和患者安全。需要0.22 µm或更小的滤器孔径来消除微生物污染物。无菌过滤工艺的一个关键考虑因素是病毒聚集体的水平。这些聚集体需要通过优化配方来控制,否则无菌过滤过程将非常棘手并可能导致产量的较高损失。

下游 - 切向流过滤
Achieve yield, efficiency and pDNA recovery goals while ensuring robust impurity removal


生物工艺液体细胞培养基和缓冲液
We offer the industry’s highest quality sterile filtered liquid capabilities, supplying ready-to-use cell culture media, buffers, CIP and SIP products from GMP facilities worldwide to optimize your biopharma production.
制成品无菌过滤和灌装
Ensure patient safety with a reliable and robust sterile filtration process.
· Final Sterile Filtration & Filling
· Sterile Filtration Strategies
· Sterile Sampling with Novaseptum® Go Sterile Sampling Solutions
· Fill-Finish with Mobius® Single-Use Fill-Finish solutions

如要继续阅读,请登录或创建帐户。
暂无帐户?



