Testowanie zanieczyszczeń nitrozoaminowych metodami LC-MS z rozdziału ogólnego Farmakopei Stanów Zjednoczonych <1469>
Tim Mueller, Site Management-Analytical, Patrik Appelblad, Senior Principal Scientist
Merck
Wprowadzenie
Nitrozoaminy są niepożądanymi produktami ubocznymi obecnymi w wielu substancjach i podejrzewa się, że mają właściwości toksyczne i rakotwórcze. W surowcach farmaceutycznych i gotowych produktach leczniczych nitrozoaminy mogą również powstawać jako produkty uboczne syntezy, podczas przechowywania lub pakowania itp. Zapotrzebowanie na analizę nitrozoamin gwałtownie wzrosło na całym świecie. Lista zanieczyszczeń nitrozoaminowych wytwarzanych z substancji leczniczych przy użyciu określonych szlaków syntetycznych wzrosła po szeroko zakrojonych ocenach szlaków syntetycznych.
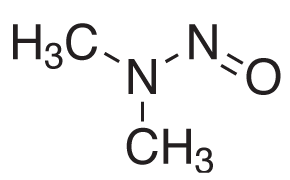
Rysunek 1.Struktura chemiczna N-nitrozodimetyloaminy (NDMA).
Farmakopea Stanów Zjednoczonych (USP) opublikowała w grudniu 2021 r. nowe procedury w odpowiedzi na nieoczekiwane wykrycie nitrozoamin, takich jak zanieczyszczenie N-nitrozodimetyloaminą (NDMA), Rysunek 1, w niektórych aktywnych składnikach farmaceutycznych (API) i odpowiadających im preparatach końcowych.1 Nowy rozdział USP <1469> zawiera zalecenia dotyczące tworzenia kontroli limitów zanieczyszczeń nitrozoaminowych w celu zapewnienia ich eliminacji lub redukcji oraz charakterystyki wydajności metod analitycznych dla procedur testowania nitrozoamin przy użyciu zarówno GC-MS (procedury 2 i 4), jak i LC-MS (procedury 1 i 3).
Niniejszy artykuł koncentruje się na procedurach testowych opartych na LC-MS (procedura 1 i 3) do analizy ilościowej znanych zanieczyszczeń nitrozoaminowych w lekach i surowcach farmaceutycznych przy użyciu chromatografii cieczowej i detekcji spektrometrycznej. Chociaż oceniano obie metody, przedstawione zostaną końcowe warunki przebiegu i dane z procedury 3. Kryteria przydatności systemu dla procedury 1 nie mogły zostać spełnione przy użyciu dostępnego oprzyrządowania, ale zostaną opisane.
Procedura 1 wyznacza użycie spektrometru mas o wysokiej rozdzielczości (HRMS) i może być stosowana do ilościowego oznaczania NDMA, NDEA (nitrozodietyloamina), NDBA (nitrozodibutyloamina), NDIPA (N-nitrozodiizopropyloamina), NEIPA (N-nitrozoetyloizopropyloamina), NMBA (kwas N-nitrozometyloaminomasłowy) i NMPA (N-nitrozometylofenyloamina) w wybranych sartanach (walsartan, irbesartan i losartan potasowy). Procedura 3 wykorzystuje MS/MS i może być stosowana do ilościowego oznaczania NDMA, NDEA, NDIPA, NEIPA, NMBA i NDBA w wybranych sartanach (walsartan, losartan potasowy, olmesartan medoksomil, kandesartan cyleksetyl i telmisartan).
Warunki eksperymentalne
Przygotowanie próbek i wzorców
Użyte wzorce i roztwory próbek przygotowano w następujący sposób:
- Roztwór wzorca wewnętrznego: Po 10 μg/ml NDMA-d6 i NMBA-d3 oraz po 1 μg/ml NDEA-d10 i NDBA-d18 przygotowano w wodzie
- Mieszanina podstawowych roztworów wzorcowych nitrozoamin: Mieszaninę zawierającą po 200 ng/ml NDMA, NEIPA, NDIPA, NDBA i NMBA przygotowano przez zmieszanie odpowiednich objętości odpowiednich wzorców referencyjnych USP i rozcieńczono wodą.
- Roztwór podstawowy wzorca NDEA: Roztwór o stężeniu 132 ng/ml NDEA został przygotowany przez rozcieńczenie USP N-Nitrozodietyloaminy RS wodą.
- Roztwory standardowe: W zależności od docelowego stężenia nitrozoaminy w próbce, przygotowano zestaw 5 kolejnych roztworów liniowości, jak opisano w Tabeli 1 z mieszaniny podstawowego roztworu wzorcowego nitrozoaminy i podstawowego roztworu wzorcowego NDEA, mieszając określone objętości każdego roztworu, jak wskazano.
- Próbki przygotowano w następujący sposób:
- 80 mg substancji leczniczej przeniesiono do 2 ml probówki wirówkowej z przykrywką.
- Dodanie 1188 μL rozcieńczalnika (1% kwas mrówkowy w wodzie) i 12 μL roztworu wzorca wewnętrznego.
- Worteksowanie przy 2500 obr/min przez 20 min (z wyjątkiem losartanu potasu, który powinien być worteksowany NMT 5 min).
- Wirowanie z prędkością około 10 000 obrotów na minutę przez 10 minut
- Przefiltrowanie do fiolki przy użyciu filtra PTFE o wielkości porów 0,45 µm.
Próbki walsartanu
Roztwór próbki walsartanu został przygotowany zgodnie z protokołem przygotowania próbki. "Walsartan" w Tabeli 8 oznacza produkt leczniczy (tabletka/tabletka w proszku).
Próbki losartanu
Roztwór próbki losartanu został przygotowany zgodnie z protokołem przygotowania próbki. "Losartan" w Tabeli 10 odpowiada tabletkom losartanu lub mielonym tabletkom losartanu
LC-MS (Procedura 3)
Rozdzielenia przeprowadzono w systemie Agilent 1290 Infinity II HPLC (Agilent, Waldbronn, Niemcy) wyposażonym w detektor 6495C triple quadrupole MS z APCI Source. Separacje chromatograficzne przeprowadzono w trybie gradientowym na kolumnie Ascentis® Express C18 (USP L1 Packing) 150×3,0 mm I.D., 2,7 µm (patrz Tabela 2-4).
Obsługa danych
Zbieranie i przetwarzanie danych przeprowadzono przy użyciu oprogramowania Masshunter w wersji 10.0.
Wyniki i dyskusja
Ocena procedury 1
.Metoda procedury 1 USP opisuje zastosowanie chromatografii cieczowej i wysokorozdzielczej detekcji spektrometrycznej mas (LC-HRMS), ale podane warunki eksperymentalne1 nie wydają się wystarczająco ogólne, aby umożliwić wdrożenie i walidację na dowolnej platformie HRMS. Nasze laboratorium doświadczyło problemów z czułością ultranowoczesnego detektora HRMS (Agilent 6546 Q-TOF), a w celu weryfikacji wyników przetestowano różne kolumny HPLC, rozpuszczalniki i odczynniki. Kryteria przydatności systemu chromatograficznego mogły zostać spełnione, ale nie było możliwe spełnienie kryteriów przydatności systemu do ogólnej identyfikacji i czułości.
Porównywalne intensywności sygnałów uzyskano przy 1 µg/ml, 100 ng/ml i 50 ng/ml dla NDEA, NEIPA, NDIPA, NDBA i NMPA (tryb dodatni ESI) przy użyciu kolumny Supelco® L43 (Ascentis® Express F5), patrz Rysunek 2 i kolumny L43 dwóch innych producentów (nie pokazano). Zanieczyszczenia NDMA nie wykryto na ŻADNEJ kolumnie na wszystkich poziomach stężenia, a NMBA nie wykryto na żadnej kolumnie w trybie ESI(-). Porównanie różnych kolumn L43 (grupy pentafluorofenylowe chemicznie związane z cząsteczkami krzemionki za pomocą przekładki propylowej) wykazało podobne ogólne zachowanie z procedurą 1 przy użyciu instrumentu LC-HRMS, ale nie było możliwe spełnienie wymagań systemu w zakresie identyfikacji i czułości. Niedawno na forum USP Pharmacopeial Forum (USP-PF) pojawiły się dalsze wyjaśnienia dotyczące procedury 1. Wspomniano w nim, że analizy zostały przeprowadzone i zwalidowane za pomocą spektrometru masowego Orbitrap Fusion Lumos Tribrid. Ponieważ ten typ oprzyrządowania nie był dostępny w naszym laboratorium, dalsza walidacja procedury 1 nie była kontynuowana.
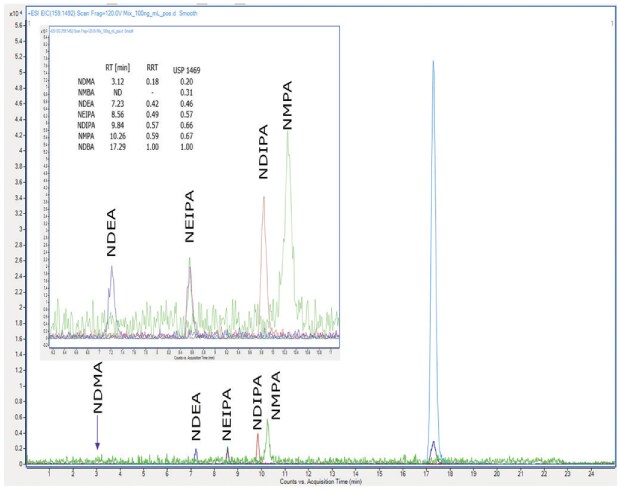
Rysunek 2.Chromatogram mieszaniny nitrozoamin o stężeniu 100 ng/mL analizowany przy użyciu kolumny Supelco® L43 (Ascentis® Express F5), tryb ESI(+).
Ocena procedury 3
Ta metoda opisuje zastosowanie chromatografii cieczowej i tandemowej detekcji spektrometrycznej mas (LC-MS/MS) do ilościowego oznaczania NDMA, NDEA, NDIPA, NEIPA, NMBA i NDBA w wybranych sartanach (walsartan, losartan potasowy, olmesartan medoksomil, kandesartan cyleksetyl i telmisartan). W procedurze wymieniono dwa kryteria przydatności systemu: 1. Współczynnik korelacji: NLT 0,99 i 2. y-Intercept: Nie więcej niż (NMT) 25% odpowiedzi roztworu o średnim stężeniu użytego do wygenerowania krzywej wzorcowej. W przyszłości przedstawione zostaną dane analityczne z prac nad ustaleniem zwalidowanej procedury analitycznej 3 przy użyciu kolumny Ascentis® Express C18 150 x 3,0 mm (opakowanie USP L1) z cząstkami 2,7 μm. Przykład wzorca zanieczyszczenia nitrozoaminą na tej kolumnie pokazano na Rysunku 3.
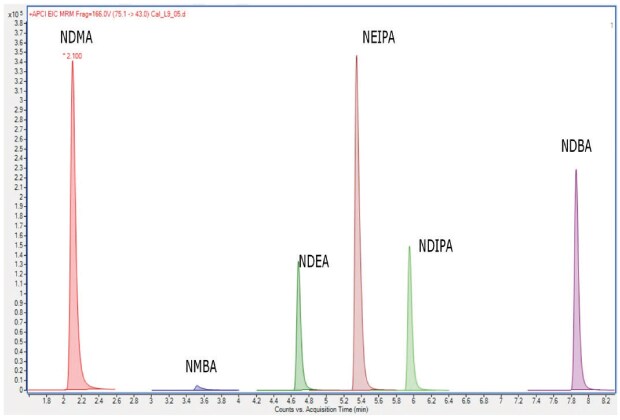
Rysunek 3.Chromatogram MRM (bez skalowania) roztworu wzorcowego nitrozoaminy o stężeniu 90 ng/ml przy użyciu kolumny Ascentis® Express C18 dla procedury 3.
Liniowość metody została określona na dziewięciu poziomach kalibracji po zoptymalizowaniu konfiguracji instrumentalnej. Wykonano potrójne wstrzyknięcia każdego roztworu liniowości. Rozdział USP <1469> określił dwa wymagania dotyczące przydatności systemu dla procedury 3. Współczynnik korelacji nie powinien być mniejszy niż (NLT) 0,99, a punkt odcięcia y dla każdego wykresu kalibracyjnego nie powinien być większy niż (NMT) 25% odpowiedzi roztworu o średnim stężeniu użytego do wygenerowania krzywej wzorcowej. Jak pokazano w Tabeli 5, oba te wymagania zostały spełnione.
Precyzję metody (Tabela 6) i dokładność (Tabela 7) określono na podstawie danych z dziesięciu wstrzyknięć poziomów kalibracji 1, 5 i 9 (L1, L5 i L9). Dokładności roztworów poziomów 1, 5 i 9 obliczono przy użyciu 9-punktowych krzywych kalibracji opisanych w Tabeli 1.
Metody granicy wykrywalności (LOD) i granicy oznaczalności (LOQ) określono przez dodanie 3,3 ng/ml (2,2 ng/ml dla NDEA) do roztworu próbki walsartanu/ losartanu i zastosowanie stosunku sygnału do szumu (S/N) do obliczeń. Granicę wykrywalności zdefiniowano jako stosunek sygnału do szumu S/N równy 3, natomiast granicę oznaczalności zdefiniowano jako stosunek S/N równy 10. Stosunek S/N został obliczony przez oprogramowanie urządzenia, gdzie stosunek S/N dla każdego piku jest ustalany automatycznie przy użyciu wysokości piku i zdefiniowanego obszaru szumu. Wynikowe wartości graniczne dla mierzonych próbek przedstawiono w Tabeli 8-11.
Specyficzność metody została określona poprzez monitorowanie czasu retencji analitów i ich względnej retencji w stosunku do retencji NDBA dla serii wstrzyknięć standardowych roztworów nitrozoaminy (n=40).
Odzysk analitu określono w jednej partii walsartanu i w jednej partii losartanu potasowego (Tabela 13). Partie substancji leczniczej zostały wzbogacone wszystkimi analitami na trzech poziomach stężenia jako triplikaty podczas procedury przygotowania próbki. Przygotowane roztwory próbek zostały zmierzone i ocenione względem zewnętrznej krzywej kalibracyjnej w celu obliczenia indywidualnego stężenia analitu. Stosunek sygnału wzorca wewnętrznego do sygnału analitu określono w roztworze próbki i w roztworach (zewnętrznego) rzędu kalibracji, tj. sygnał NDMA-D6 / sygnał NDMA. Następnie stosunki sygnałów wykorzystano do obliczenia stężenia w roztworze próbki w stosunku do roztworów kalibracyjnych.
Podczas określania odzysku analitu zaobserwowano systematyczny problem z określeniem odzysku spike dla NDBA (dane nie pokazane), ponieważ znalezione stężenia tego analitu były zawsze zbyt wysokie (odzysk > 130%, a zatem wykluczone).
Analiza możliwych przyczyn tego problemu wykazała, że podczas elucji NDBA występuje koelucja z jedną lub kilkoma nieznanymi substancjami.
Wnioski
Niniejszy artykuł przedstawia intrygujące wyniki pracy z rozdziałem USP <1469>, Procedura 1 i udane wdrożenie Procedury 3 spełniającej wszystkie wymagania dotyczące przydatności systemu.
W celu oznaczenia N-nitrozoamin w walsartanie metodą GC-MS/MS zobacz artykuł Oznaczanie N-nitrozoamin w walsartanie
Więcej informacji na tematy związane z kontrolą jakości w farmacji można znaleźć na stronie SigmaAldrich.com/PharmaQC
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?