Co to jest koniugat przeciwciało-lek?
Koniugaty przeciwciało-lek (ADC) to szybko rozwijająca się metoda leczenia stosowana głównie w terapii nowotworów. Na początku 2023 r. w fazie rozwoju klinicznego znajduje się ponad 213 ADC i 13 ADC zatwierdzonych przez FDA.1
Co to jest koniugat przeciwciało-lek?
Koniugat ADC składa się z przeciwciała monoklonalnego sprzężonego z ładunkiem leku za pośrednictwem łącznika. Kompleks ten kieruje lek do określonego typu komórek (np. komórek nowotworowych) w celu uzyskania efektu terapeutycznego. Selektywność mAb wpływa na komórkę nowotworową, oszczędzając zdrowe komórki.
W porównaniu do tradycyjnej chemioterapii, ADC mają wiele zalet, w tym:
- Selektywność wobec nowotworów
- Dłuższy okres półtrwania
- Ulepszone profile bezpieczeństwa (choć nadal bardzo silne, wykazują zmniejszoną toksyczność ogólnoustrojową)
Składniki koniugatu przeciwciało-lek
Istnieją trzy podstawowe składniki ADC: przeciwciało, ładunek i łącznik (rysunek 1).
- Przeciwciało monoklonalne: Przeciwciało stosowane w ADC powinno być specyficzne dla antygenu związanego z nowotworem, który ma ograniczoną ekspresję na normalnych komórkach. Większość stosowanych przeciwciał to humanizowane lub ludzkie przeciwciała monoklonalne.2
- Linker: Łącznik przyłącza ładunek (czynnik cytotoksyczny) do przeciwciała. Jest on zaprojektowany tak, aby był stabilny w obiegu i uwalniał ładunek po dostaniu się do komórek docelowych. Łączniki mogą mieć wiele cech (np. rozszczepialne lub nierozszczepialne) i mogą wpływać na rozpuszczalność ADC, stabilność, toksyczność i inne czynniki.
- Ładunek: Ładunek jest przeznaczony do zabijania komórek docelowych po ich internalizacji i uwolnieniu. Te ładunki są często lekami, które są wysoce toksyczne i wymagają przeciwciał, aby specyficznie celować w komórki nowotworowe, tak aby nie wpływały na zdrowe komórki. Synteza ładunku jest złożonym procesem, ale wykorzystanie półproduktów ADC może przyspieszyć i uprościć dostęp do wysoce silnych API (HPAPI).
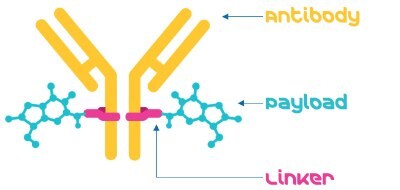
Rysunek 1.Koniugat przeciwciało-lek składa się z przeciwciała, łącznika i ładunku.
Jak działają koniugaty przeciwciało-lek?
W przypadku większości ADC z ładunkiem cytotoksycznym, kaskada etapów prowadzi do zabicia komórki nowotworowej (rysunek 2):
- Wiązanie: Część przeciwciała ADC wiąże antygen na komórce nowotworowej.
- Wchłanianie: ADC jest internalizowany w komórce i wchodzi na ścieżkę endosom-lizosom.
- Degradacja przeciwciała: ADC jest degradowany przez lizosom, oddzielając ładunek od zdegradowanego przeciwciała i łącznika.
- Uwolnienie ładunku: Toksyczny ładunek jest uwalniany z lizosomu do cytoplazmy/jądra komórki nowotworowej.
- Niszczenie DNA lub mikrotubul: Po uwolnieniu, ładunek dociera do celu międzykomórkowego (np. zaburzając DNA lub mikrotubule komórki nowotworowej).
- Śmierć komórki: Mechanizm działania ładunku powoduje śmierć komórki nowotworowej.
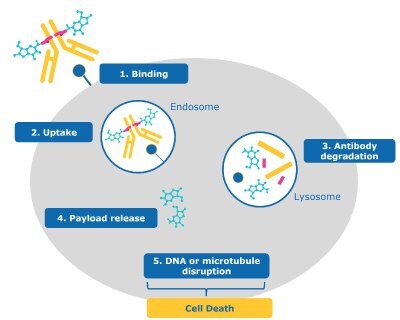
Rysunek 2.Mechanizm działania ADC w celu zwalczania i zabijania komórek (1) wiązanie, (2) wychwyt, (3) degradacja przeciwciała, (4) uwalnianie ładunku, (5) zakłócenie DNA lub mikrotubul oraz (6) śmierć komórki.
Uwagi dotyczące projektowania i rozwoju ADC
Ponieważ ADC składają się z wielu komponentów, które mają różny wpływ na ADC, ich projektowanie nie jest trywialne. Oprócz optymalizacji mAb, ładunku i łącznika, ich koniugacja wiąże się z dodatkowymi kwestiami:
- Miejsce koniugacji (stochastyczne kontra specyficzne dla miejsca)
- Wpływ koniugacji na mAb: Zmiany w mAb mogą wpływać na jego właściwości biologiczne, takie jak stabilność lub skuteczność celowania. Ważne jest, aby wziąć pod uwagę te efekty przy wyborze łącznika i ładunku.
- Optymalizacja stosunku leku do przeciwciała: Stosunek leku do przeciwciała (DAR) to średnia liczba cząsteczek leku sprzężonych z przeciwciałem. Niski DAR może zmniejszyć skuteczność ADC, ale wysoki DAR może negatywnie wpłynąć na strukturę przeciwciała, stabilność lub wiązanie przeciwciała.
- Agregacja ładunku: Niektóre ładunki, takie jak pirolobenzodiazepiny, są hydrofobowe i mogą powodować agregację ADC. Czasami integracja solubilizatora rozwiązuje lub nawet poprawia rozpuszczalność i skuteczność ADC.
- Oczyszczanie po reakcji koniugacji przeciwciała z lekiem: W wyniku reakcji koniugacji powstaje mieszanina ADC z DAR, wolnym lekiem i cząsteczkami łącznikowymi oraz różnymi rozpuszczalnikami, które należy usunąć.
Uwagi dotyczące rozwoju i produkcji kontraktowej ADC
Ze względu na złożoność i wymagania dotyczące przechowywania ADC, wiele firm deweloperskich zwraca się do CTDMO (Contract Testing, Development and Manufacturing organizations) lub CDMO (Contract Development, Manufacturing Organizations) w celu opracowania, wyprodukowania i przetestowania ADC.
Organizacje CTDMO, oferujące kompleksowe usługi w zakresie wprowadzania ADC i biokoniugatów do klinik i komercjalizacji, mogą być preferowaną opcją, gdy poszukuje się zintegrowanego i niezawodnego łańcucha dostaw od rozwoju linii komórkowej do testowania substancji leczniczej luzem. Dodanie wiedzy specjalistycznej w zakresie wsparcia regulacyjnego dla płynnego zwiększania skali (IND, PPQ, BLA/NDA) i innowacyjnych technologii w celu przyspieszenia odkrywania i opracowywania leków.
Dla deweloperów zainteresowanych generowaniem ADC, ale wymagających wiedzy specjalistycznej lub możliwości koniugacji, nasze usługi ADC Express Services™ wykorzystują nasze rozległe doświadczenie w biokoniugacji, aby zapewnić biblioteki ADC klasy rozwojowej w celu wyboru najlepszego kandydata.
Biokoniugaty nowej generacji i przyszłość ADC
Podczas gdy tradycyjne ADC wykorzystują przeciwciało monoklonalne w połączeniu z pancytotoksyczną małą cząsteczką, biokoniugaty nowej generacji przyjęły model biokoniugatu do łączenia różnych formatów przeciwciał (np: fragment regionu wiążącego antygen (region Fab), jednołańcuchowe zmienne fragmenty (scFv) i nanoprzeciwciała) z różnymi ładunkami (np.małymi cząsteczkami, radionuklidami, białkami i oligonukleotydami) (rysunek 3). Takie nowatorskie podejście do biokoniugatów otwiera drzwi do nowych mechanizmów działania, terapii i wskazań.
Tradycyjny

Rysunek 3a.mAb jako składnik adc lub biokoniugatu
Rysunek 3b.Ładunek lub pancytotoksyczna mała cząsteczka jako składnik adc lub biokoniugatu.
Wchodzące na rynek

Rysunek 3c.Bispecyficzne przeciwciała i oparte na fragmentach konstrukty bi-/ultispecyficzne do dostarczania ładunku.
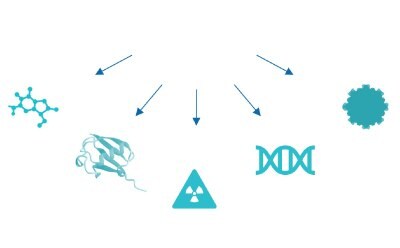
Rysunek 3d.Mała cząsteczka, białko, nuklid promieniotwórczy, oligonukleotyd, nanocząsteczka.
Podejmij kolejny krok w kierunku szybkiego i bezpiecznego wprowadzenia projektu na rynek, rozmawiając z jednym z naszych ekspertów technicznych.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?