Elektrochemia na stanowisku pracy i w terenie
Florika C. Macazo, Ph.D
Electrochemistry Product Manager, Bioanalytical Systems, Inc. (BASi), West Lafayette, IN
Elektrochemia to dziedzina chemii zajmująca się badaniem reakcji chemicznych, które wytwarzają prądy i potencjały elektryczne. Od dziesięcioleci jest szeroko stosowana w środowisku akademickim i przemysłowym do niezliczonych zastosowań w obszarach wykrywania małych cząsteczek, biochemii, magazynowania i konwersji energii, baterii, korozji, badań materiałów, osadzania i elektrosyntezy organicznej.
Zestaw ogniwa elektrochemicznego składa się z dwóch lub trzech elektrod umieszczonych w małej celi lub fiolce. W przypadku zestawu 2-elektrodowego ogniwo zawiera elektrodę roboczą (WE) i elektrodę przeciwną (CE). Mierzona jest różnica potencjałów między WE i CE, podczas gdy prąd jest równy i przeciwny na obu elektrodach. Podobnie, zestaw 3-elektrodowy obejmuje WE i CE, z dodatkiem trzeciej elektrody - czyli elektrody odniesienia (RE). W tym przypadku różnica potencjałów jest mierzona między WE i RE, podczas gdy prąd jest nadal równy i przeciwny na WE i CE. Istotną zaletą tej ostatniej jest możliwość rozróżnienia lub oddzielenia pomiarów prądu i potencjału, co zapewnia lepszą kontrolę nad pomiarem elektrochemicznym.
Jak pokazano na rysunku 1, różne czynniki wpływają na sygnał wytwarzany w ogniwie elektrochemicznym. Niektóre z tych parametrów mogą być manipulowane przez użytkownika końcowego, takie jak materiał i geometria elektrody, zmienne elektryczne (np. zastosowany potencjał itp.) oraz warunki zewnętrzne (np. temperatura itp.), podczas gdy niektóre są trudniejsze do kontrolowania, takie jak transfer masy i zmienne roztworu (np. dyfuzja, adsorpcja itp.). Niezależnie od tego, konieczne jest dostrojenie parametrów, które można kontrolować w celu wygenerowania powtarzalnych i ilościowych danych elektrochemicznych. Wybór materiału elektrody, który zależy od wykonywanego pomiaru i ogólnego zastosowania prowadzonego badania, może znacznie zwiększyć wskaźnik sukcesu.
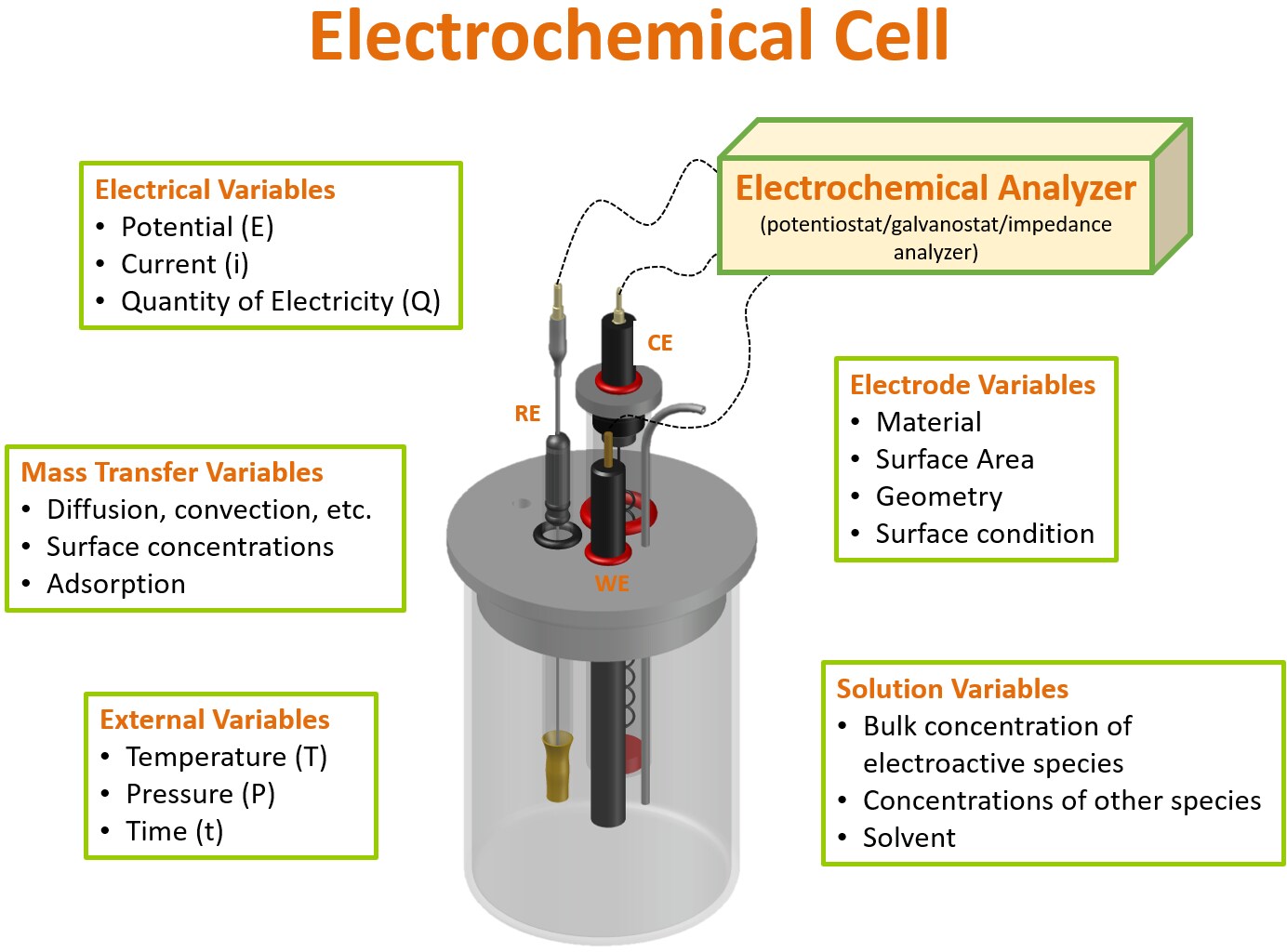
Rysunek 1. Trójelektrodowy układ elektrochemiczny i zmienne wpływające na pomiar elektrochemiczny.
Elektrody do badań elektrochemicznych
Elektrody odniesienia
Elektrody odniesienia (RE) mierzą i stosują potencjał między elektrodami z wysokim stopniem precyzji. Zastosowanie elektrody odniesienia umożliwia dokładne porównanie odczytów potencjału między różnymi eksperymentami ze względu na jej zdolność do oddzielania pomiarów potencjału i prądu w ogniwie elektrochemicznym. Wybór odpowiedniej elektrody odniesienia dla danego eksperymentu ma kluczowe znaczenie, ponieważ powinna ona posiadać ważne właściwości, takie jak stabilny i powtarzalny potencjał w czasie, niepolaryzowalność, niska rozpuszczalność i odwracalne sprzężenie, które jest zgodne z równaniem Nernsta.
Elektrody referencyjne do wodnych badań elektrochemicznych
Wspólne elektrody referencyjne stosowane w środowisku wodnym obejmują wodór, chlorek srebra/srebra (Ag/AgCl) i elektrody kalomelowe (Hg/Hg2Cl2). Elektroda odniesienia Ag/AgCl jest najczęściej stosowaną wodną elektrodą odniesienia ze względu na jej stabilność, łatwość użycia oraz wygodną konstrukcję i utylizację. Ta elektroda odniesienia może być montowana przy użyciu 3M (lub nasyconych) roztworów elektrolitu chlorku sodu lub chlorku potasu. Chociaż ten RE zapewnia wystarczające właściwości wymagane dla elektrody odniesienia, nie jest pozbawiony wad. Jej wady obejmują ciekłe potencjały złącza, zanieczyszczenie roztworu rozpuszczalnika wodą i wytrącanie się osadu na frycie, co może powodować zakłócenia w odczycie elektrycznym. W przypadku uszkodzenia fryty (np. zablokowania, odbarwienia, pęknięcia, wyszczerbienia itp.) elektrodę referencyjną można wyczyścić i zregenerować poprzez wymianę fryty CoralPor® i roztworu elektrolitu w komorze referencyjnej.
Zalecenia dotyczące produktu: |
|---|
Elektroda odniesienia do niewodnych badań elektrochemicznych
Specyficzne badania obejmują niewodne, organiczne warunki. Ponieważ skład roztworu i stężenie obecnych w nim substancji elektroaktywnych przyczyniają się głównie do sygnału elektrochemicznego, zastosowanie kompatybilnej, funkcjonalnej elektrody odniesienia w tym środowisku ma kluczowe znaczenie dla powodzenia pomiaru. Chociaż nie ma wielu dostępnych na rynku elektrod odniesienia do niewodnych badań elektrochemicznych, elektroda odniesienia Ag/Ag+ zyskała popularność wśród badaczy w tej dziedzinie. W tym przypadku srebrny drut styka się z roztworem jonów srebra, zwykle dostarczanym przez AgNO3, AgClO4 lub inne sole srebra w wybranym elektrolicie. Często elektrolit w przedziale referencyjnym jest taki sam jak elektrolit roztworu. Wiele badań w literaturze naukowej donosi o stosowaniu różnych soli, takich jak nadchloran tetrabutyloamonu (TBAP), nadchloran tetraetyloamonu (TEAP), heksafluorofosforan tetrabutyloamonu i fluoroboran tetrabutyloamonu. Typowe polarne lub dipolarne rozpuszczalniki aprotonowe stosowane do rozpuszczania tych soli organicznych obejmują acetonitryl (ACN), dimetyloformamid (DMF), dimetylosulfotlenek (DMSO) i węglan propylenu (PC). W przypadkach, gdy sól nie jest wystarczająco rozpuszczalna w rozpuszczalniku (np. chlorek metylenu, tetrahydrofuran itp.), Zaleca się stosowanie bardziej polarnego, ale mieszalnego rozpuszczalnika, takiego jak acetonitryl.
Zalecenia dotyczące produktu: |
|---|
***Zestaw ten zawiera materiały wymagane do budowy niewodnej elektrody odniesienia jonów srebra/srebra. Szklany korpus elektrody ma porowatą frytę CoralPor® przymocowaną za pomocą rurki termokurczliwej. Zdejmowany teflonowy wierzchołek zawiera srebrny przewód i pozłacany pin łączący 0,060" dla przewodu ogniwa. Zestaw zawiera również stały azotan srebra, dodatkowe rurki termokurczliwe i dodatkowe porowate końcówki CoralPor®. Rozpuszczalniki niewodne muszą być dostarczone przez użytkownika.
Elektrody robocze
Elektrody robocze (WE) zapewniają powierzchnię przewodzącą, na której zachodzi reakcja elektrochemiczna. Po przyłożeniu potencjału, elektroaktywna powierzchnia danej elektrody roboczej umożliwia transfer elektronów do i z ciekłego roztworu, wytwarzając odpowiedź prądową, która daje odczyt elektrochemiczny. Prąd wynikający z przyłożonego potencjału jest równy i przeciwny na powierzchni elektrody roboczej i przeciwnej. Wybór odpowiedniej elektrody roboczej różni się w zależności od zastosowania, jednak musi ona być generalnie obojętna, przewodząca i zapewniać wydajną kinetykę i termodynamikę transferu elektronów, aby ułatwić spójne i bardzo czułe pomiary elektrochemiczne.
Na przestrzeni lat badano i stosowano różne materiały jako elektrody robocze; jednak najbardziej ugruntowane są platyna, złoto i węgiel szklisty. Inne materiały obejmują miedź, nikiel, cynk i srebro. Niezwykle ważne jest, aby powierzchnia elektrody roboczej była bardzo czysta i miała wystarczającą chropowatość do zajścia reakcji elektrochemicznej. Jeśli powierzchnia elektrody roboczej jest zabrudzona zanieczyszczeniami (np. cząsteczkami dyfundującymi z roztworu lub cząsteczkami utkniętymi na powierzchni elektrody), ma to ogromny wpływ na kinetykę transferu elektronów i odpowiedź prądową gatunków redoks w roztworze, co skutkuje niereprodukowalnymi danymi. W takim przypadku może być konieczne oczyszczenie i wstępne przygotowanie elektrody poprzez przepłukanie jej dużą ilością wody dejonizowanej i/lub metanolu w celu usunięcia zaadsorbowanych substancji. Uporczywe zanieczyszczenia lub cząstki organiczne mogą wymagać ręcznego polerowania zawiesiną diamentu lub tlenku glinu nałożoną na mikrościereczkę lub pad polerski. Zawsze postępuj od grubych do drobnych materiałów w postępie polerowania, z dokładnym płukaniem i wymianą padów między każdym krokiem.
Zalecenia dotyczące produktu: |
|---|
Elektrody przeciwne
Elektrody przeciwne (CE) są wysoce obojętnymi, przewodzącymi elektrodami metalowymi wykorzystywanymi do "przeciwdziałania" lub równoważenia elektrochemii zachodzącej na elektrodzie roboczej i zapewniają źródło lub pochłaniacz elektronów w ogniwie. Potencjał elektrody przeciwnej jest określany przez elektrochemię zachodzącą na jej powierzchni. Oprócz właściwości wspomnianych powyżej, przeciwelektroda powinna mieć generalnie większą powierzchnię niż elektroda robocza, aby uniknąć przeciążenia prądem. Do tej pory materiały stosowane jako przeciwelektrody obejmowały platynę o różnych geometriach (np. drut, flagę lub gazę), pręt grafitowy, stal nierdzewną, złoto i srebro.
Zalecenie dotyczące produktu: |
|---|
Techniki badań elektrochemicznych
Metodologie elektrochemiczne
Od czasu wprowadzenia elektrochemii do badań akademickich i przemysłowych opracowano i zastosowano kilka technik elektrochemicznych. Pożądane dane ilościowe dyktują preferencje dla jednej techniki elektrochemicznej nad drugą i różnią się w zależności od użytkownika końcowego. Pomiary elektrochemiczne są zwykle uzyskiwane za pomocą woltamperometrii, amperometrii, kulometrii, potencjometrii i spektroskopii impedancyjnej (rysunek 2), chociaż woltamperometria cykliczna jest najczęściej stosowaną podstawową techniką elektrochemiczną.

Rysunek 2.Techniki elektrochemiczne.
Woltamperometria cykliczna (CV) oferuje doskonałą technikę wstępnej charakterystyki, ponieważ dostarcza przydatnych informacji na temat kinetyki transferu elektronów, termodynamiki, stabilności i adsorpcji gatunków redoks-aktywnych w roztworze. Poniżej znajduje się przykład zastosowania CV w wykrywaniu rzeczywistych próbek, takich jak acetaminofen.
Elektrochemia w terenie: Wykrywanie małych cząsteczek za pomocą woltamperometrii cyklicznej
Acetaminofen (N-acetylo-p-aminofenol, APAP), aktywny składnik Tylenolu, jest szeroko stosowanym środkiem przeciwbólowym. Jednym z efektów ubocznych jest jednak to, że przy podawaniu w dużych dawkach może dojść do uszkodzenia wątroby i nerek. Jedną z podstawowych metod metabolizmu w wątrobie jest utlenianie leku. Dlatego korzystne jest zbadanie chemii utleniania (redoks) acetaminofenu i jego metabolitów. Jako monopodstawiony aminofenol jest on aktywny elektrochemicznie. Zachowanie woltamperometryczne wskazuje na 2-elektronowe utlenianie przy umiarkowanym potencjale ze znaczną, ale nie idealną odwracalnością (Rysunek 3). Zmieniając pH roztworu i szybkość skanowania eksperymentu, można wyodrębnić informacje i połączyć je w celu wyjaśnienia mechanizmu.
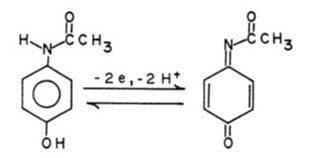
Rysunek 3. Dwuelektronowe, dwuprotonowe utlenianie acetaminofenu do elektrochemicznie aktywnego związku pośredniego.
Ten przykład przedstawia praktyczne zastosowanie CV do określania ilościowego stężenia i informacji mechanistycznych. Oferując alternatywę dla bardziej konwencjonalnych metod stosowanych w wykrywaniu niektórych leków małocząsteczkowych, pomiary CV mogą być wykorzystane ilościowo do określenia nieznanego stężenia acetaminofenu w tabletce acetaminofenu, a jakościowo do wykazania informacji mechanistycznych. W tym badaniu ogniwo elektrochemiczne zostało zmontowane poprzez umieszczenie elektrody roboczej z węgla szklistego (GCE) (BASMF2012-1EA), elektrody pomocniczej z drutu platynowego (BASMW1032-1EA) i elektrodę odniesienia Ag/AgCl (BASMF2052-1EA) w analizowanym roztworze. Uzyskano CV dla pięciu roztworów wzorcowych w celu ustalenia krzywej kalibracyjnej (Rysunek 4) oraz braku lub obecności nasycających stężeń acetaminofenu (Rysunek 5) w celu zbadania elektrochemicznego utleniania acetaminofenu.
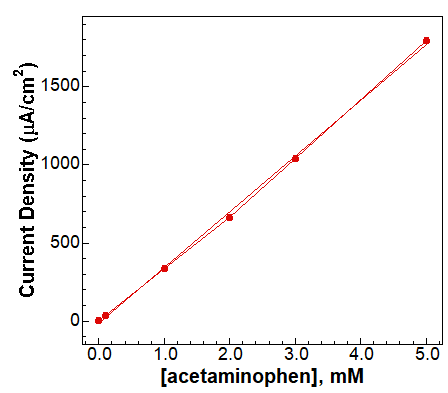
Rysunek 4. Krzywa kalibracji - wzorce acetaminofenu.
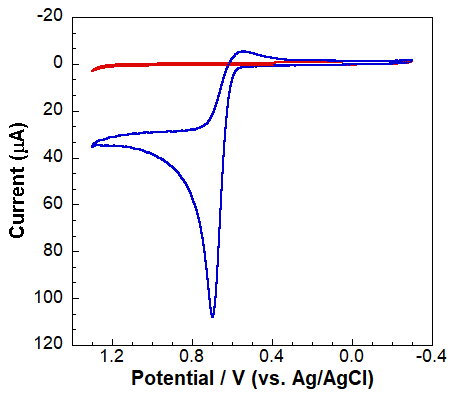
Rysunek 5.CV GCE przy braku (czerwony) i obecności acetaminofenu (niebieski).
Rysunek 5. CV GCE w nieobecności (czerwony) i obecności acetaminofenu (niebieski).
Pojedyncze, dość dobrze zdefiniowane piki katodowe i anodowe wskazują, że zaangażowane są tylko dwa gatunki elektroaktywne. Na Rysunku 5 fala anodowa reprezentuje utlenianie acetaminofenu, podczas gdy fala katodowa reprezentuje reakcję odwrotną (redukcję do acetaminofenu). Przy niższym pH roztwór jest wystarczająco kwaśny, aby protonować utlenione formy (rysunek 3), dając stosunkowo niestabilny, ale elektrochemicznie aktywny związek pośredni. Ten związek pośredni szybko ulega hydratacji, tworząc elektrochemicznie nieaktywny gatunek, jak pokazano na Rysunku 5. Brak dobrze zdefiniowanego prądu katodowego wskazuje, że każdy półprodukt generowany przez utlenianie szybko ulega reakcji chemicznej, tworząc nieaktywny elektrochemicznie gatunek. Korzystając z krzywej kalibracyjnej (Rysunek 4) i woltamogramów uzyskanych dla nieznanego (Rysunek 6, szacowane stężenia rozcieńczonej i stężonej nieznanej tabletki acetaminofenu wynoszą odpowiednio 1,99 ± 0,15 mM i 4,15 ± 1,49 mM).
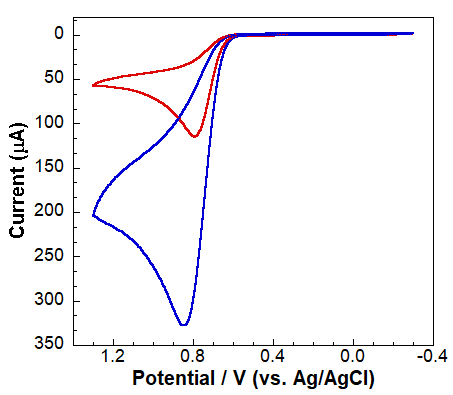
Rysunek 6. CV GCE w rozcieńczonych (czerwony) i stężonych (niebieski) nieznanych roztworach.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?