Drugorzędne standardy farmaceutyczne
Nasze normy wtórne mają możliwość wielokrotnego śledzenia w odniesieniu do norm pierwotnych USP, EP i BP; ponadto są one wytwarzane zgodnie z normami ISO/IEC 17025 i ISO Guide 17034.
FDA i EP uznają stosowanie norm wtórnych lub norm roboczych, które zostały ustanowione w odniesieniu do odpowiedniej normy pierwotnej. Zobacz szczegółowe informacje na temat Regulatory Recognition of Secondary Standards.
Cechy i zalety
Ważne cechy produktu to:
- Traceability to United States Pharmacopeia (USP); also to European Pharmacopoeia (EP) and British Pharmacopoeia (BP), if available
- Analysis performed on instruments validated according to GMP using pharmacopeia monograph methods
- Certyfikowana wartość zgodnie z przewodnikiem ISO 17034 i ISO 17025 przy użyciu metody bilansu masy
- Certyfikat zgodności zgodnie z przewodnikiem ISO 31
Główną korzyścią jest:
- Eliminacja czasu i wysiłku związanego z przygotowaniem i walidacją własnych norm roboczych
Comprehensive Certification
Wartości na certyfikacie są zawsze identyfikowalne z aktualnymi partiami farmakopei.
Uwaga: Jeśli ważna partia farmakopei ulegnie zmianie, odpowiednia norma wtórna zostanie ponownie certyfikowana z możliwością śledzenia do nowej partii, a nowy certyfikat zostanie udostępniony online.
Z tego powodu certyfikat należy zawsze pobrać ze strony internetowej przed użyciem materiału!
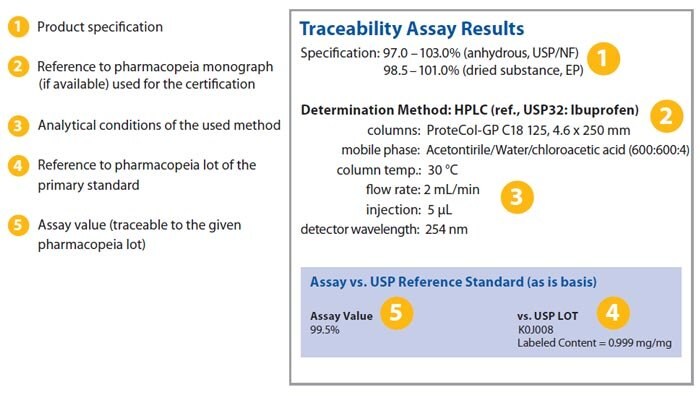
Certyfikat zawiera następujące dane:
- Wyniki testu identyfikowalności w porównaniu z pierwotnymi standardami farmakopei
- Wartość według bilansu masy (zgodnie z ISO 17025)
- Instrukcje obsługi i przechowywania
- Dane analityczne
Wyciąg z certyfikatu pokazano na poniższym obrazku, podkreślając niektóre z kluczowych informacji, które są wyświetlane.
Miesięczne aktualizacje COA Pharma Secondary Standards:
Klienci są powiadamiani z wyprzedzeniem o wszelkich zmianach COA, które mogą wystąpić z powodu ponownej kwalifikacji itp.
Usługa ta pomaga użytkownikom zapewnić, że zawsze mają najbardziej aktualną wersję certyfikatu produktu.
Regulatory Recognition of Secondary Standards
(1) Human Drug CGMP Notes, Vol 9, Number 3, 2001 (Internal FDA Publication):
Q: Czy firma może używać wzorców referencyjnych ze źródeł innych niż USP?
O: Tak. Korzystanie ze źródła innego niż USP może być dopuszczalne pod warunkiem, że wzorzec referencyjny obejmuje krytyczne właściwości charakterystyczne, jest odpowiedni do zamierzonego celu i jest poparty pełną dokumentacją..... Certyfikat analizy dostawcy powinien zawierać wyniki badań w celu odpowiedniego scharakteryzowania materiału w pełnym zakresie cech jakościowych.
(2) FDA: Guidance for Industry; Analytical Procedures and Methods Validation, sierpień 2000:
"Wzorzec odniesienia (tj. wzorzec podstawowy) można uzyskać z USP/NF lub innych oficjalnych źródeł (np. CBER, 21 CFR 610.0). Wzorzec roboczy (tj. wzorzec wewnętrzny lub wtórny) to wzorzec, który jest kwalifikowany i stosowany zamiast wzorca odniesienia."
(3) Farmakopea Europejska, Rozdział 5.12:
"Wzorzec wtórny: Wzorzec ustalony przez porównanie z wzorcem pierwotnym. Wzorzec wtórny może być stosowany do celów rutynowej kontroli jakości dla dowolnego z zastosowań opisanych powyżej dla wzorców pierwotnych, pod warunkiem, że jest on ustalony w odniesieniu do wzorca pierwotnego."
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?