Wszystkie zdjęcia(1)
Kluczowe dokumenty
S1826
Sialic Acid Aldolase from Escherichia coli K12
recombinant, expressed in E. coli BL21, ≥3.0 units/mg protein
Synonim(y):
N-Acetylneuraminate lyase, N-Acetylneuraminate pyruvate-lyase (N-acetyl-D-mannosamine-forming)
Zaloguj sięWyświetlanie cen organizacyjnych i kontraktowych
About This Item
Polecane produkty
rekombinowane
expressed in E. coli BL21
Poziom jakości
Formularz
lyophilized powder
aktywność właściwa
≥3.0 units/mg protein
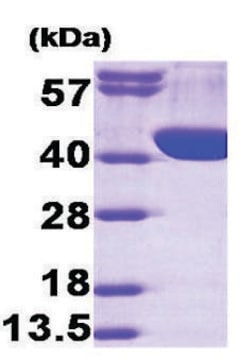
masa cząsteczkowa
33.4 kDa
Warunki transportu
dry ice
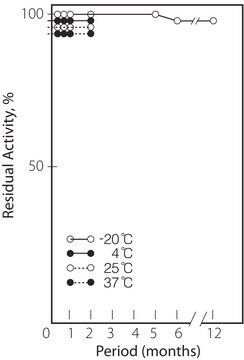
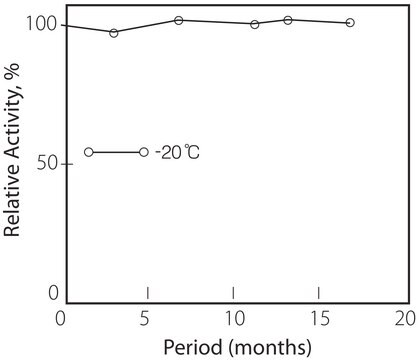
temp. przechowywania
−20°C
Opis ogólny
Sialic acid aldolases, or N-acetylneuraminate lyases, catalyze the reversible aldol cleavage of N-acetylneuraminic acid to form pyruvate and N-acetyl-D-mannosamine. In nature, N-acetylneuraminate lyase mainly occurs in pathogens.
Zastosowanie
Sialic acid aldolase can be used to synthesize unnatural sugars of C(6) to C(10) for the design of antagonists and inhibitors of glycoenzymes.
Definicja jednostki
One unit will catalyze the formation of 1.0 μmol Neu-5-Ac from Man-N-Ac and pyruvate per minute at 37°C at pH 8.0.
Postać fizyczna
Lyophilized powder containing Tris-HCl and NaCl
Komentarz do analizy
Enzymatic activity assays are performed in Tris-HCl buffer (100 mM, pH 7.5) containing Neu-5-Ac (10 mM) at 37 °C for 15 min and analyzed using capillary electrophoresis with UV detection at 200 nm.
Ta strona może zawierać tekst przetłumaczony maszynowo.
Hasło ostrzegawcze
Warning
Zwroty wskazujące rodzaj zagrożenia
Zwroty wskazujące środki ostrożności
Klasyfikacja zagrożeń
Eye Irrit. 2 - Skin Irrit. 2 - STOT SE 3
Kod klasy składowania
11 - Combustible Solids
Klasa zagrożenia wodnego (WGK)
WGK 3
Temperatura zapłonu (°F)
Not applicable
Temperatura zapłonu (°C)
Not applicable
Wybierz jedną z najnowszych wersji:
Masz już ten produkt?
Dokumenty związane z niedawno zakupionymi produktami zostały zamieszczone w Bibliotece dokumentów.
Klienci oglądali również te produkty
Modulation of substrate specificities of D-sialic acid aldolase through single mutations of Val-251.
Chien-Yu Chou et al.
The Journal of biological chemistry, 286(16), 14057-14064 (2011-01-29)
In a recent directed-evolution study, Escherichia coli D-sialic acid aldolase was converted by introducing eight point mutations into a new enzyme with relaxed specificity, denoted RS-aldolase (also known formerly as L-3-deoxy-manno-2-octulosonic acid (L-KDO) aldolase), which showed a preferred selectivity toward
Guiomar Sánchez-Carrón et al.
Applied and environmental microbiology, 77(7), 2471-2478 (2011-02-15)
N-Acetylneuraminate lyases (NALs) or sialic acid aldolases catalyze the reversible aldol cleavage of N-acetylneuraminic acid (Neu5Ac) to form pyruvate and N-acetyl-d-mannosamine (ManNAc). In nature, N-acetylneuraminate lyase occurs mainly in pathogens. However, this paper describes how an N-acetylneuraminate lyase was cloned
Jozef Nahálka et al.
Organic & biomolecular chemistry, 7(9), 1778-1780 (2009-07-11)
Active inclusion bodies of polyphosphate kinase 3 and cytidine 5'-monophosphate kinase were combined with whole cells that co-express sialic acid aldolase and CMP-sialic acid synthetase. The biocatalytic mixture was used for the synthesis of CMP-sialic acid, which was then converted
Nasz zespół naukowców ma doświadczenie we wszystkich obszarach badań, w tym w naukach przyrodniczych, materiałoznawstwie, syntezie chemicznej, chromatografii, analityce i wielu innych dziedzinach.
Skontaktuj się z zespołem ds. pomocy technicznej