Wszystkie zdjęcia(1)
Kluczowe dokumenty
L5135
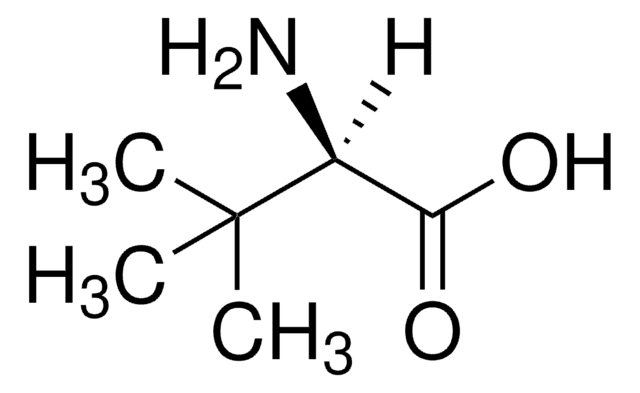
L-Leucine Dehydrogenase from Bacillus cereus
lyophilized powder, ≥60 units/mg protein
Synonim(y):
L-Leucine:NAD+ oxidoreductase (deaminating)
Zaloguj sięWyświetlanie cen organizacyjnych i kontraktowych
About This Item
Numer CAS:
Numer MDL:
Kod UNSPSC:
12352204
NACRES:
NA.54
Polecane produkty
Formularz
lyophilized powder
Poziom jakości
aktywność właściwa
≥60 units/mg protein
masa cząsteczkowa
245 kDa
temp. przechowywania
−20°C
Szukasz podobnych produktów? Odwiedź Przewodnik dotyczący porównywania produktów
Opis ogólny
Dehydrogenaza L-leucyny należy do rodziny dehydrogenaz aminokwasowych.
Zastosowanie
Dehydrogenaza L-leucyny z Bacillus cereus została wykorzystana do spektrofotometrycznego oznaczania aminokwasów rozgałęzionych (BCAA) w próbkach surowicy.
Działania biochem./fizjol.
Dehydrogenaza leucynowa jest oksydoreduktazą zależną od wodoru dinukleotydu nikotynamidoadeninowego (NADH). Bierze udział w katalizowaniu redukcyjnego aminowania alifatycznych 2-okso-kwasów do ich odpowiednich L-aminokwasów.
Definicja jednostki
One unit will convert 1.0 μmole of L‑leucine to α-ketoisocaproate per min at pH 10.5 at 37 °C.
Inne uwagi
contains lysine
Ta strona może zawierać tekst przetłumaczony maszynowo.
Kod klasy składowania
11 - Combustible Solids
Klasa zagrożenia wodnego (WGK)
WGK 3
Temperatura zapłonu (°F)
Not applicable
Temperatura zapłonu (°C)
Not applicable
Środki ochrony indywidualnej
Eyeshields, Gloves, type N95 (US)
Wybierz jedną z najnowszych wersji:
Masz już ten produkt?
Dokumenty związane z niedawno zakupionymi produktami zostały zamieszczone w Bibliotece dokumentów.
K Selber et al.
Journal of chromatography. B, Biomedical sciences and applications, 743(1-2), 21-30 (2000-08-15)
Mathematical strategies were applied to optimise the extraction of recombinant leucine dehydrogenase from E. coli homogenates and endoglucanase 1 from culture filtrates of Trichoderma reesei in polyethylene glycol-phosphate systems. The goal was to test mathematical tools which could facilitate the
M B Ansorge et al.
Applied microbiology and biotechnology, 53(6), 668-673 (2000-08-05)
The established Escherichia coli expression vectors ptrc99a, pKK223-3, pPLlambda, pAsk75, pRA95, and pRA96, which differ in copy number, mode of induction, selection marker, and use of par sequences for stabilization, were investigated for the stable expression of recombinant L-leucine dehydrogenase
S Guangdong et al.
The Journal of antibiotics, 54(1), 66-73 (2001-03-28)
Shengjimycin is a group of 4"-acylated spiramycins with 4"-isovalerylspiramycin as the major component, produced by recombinant S. spiramyceticus F21 harboring a 4"-O-acyltransferase gene from S. mycarofaciens 1748. A stable bioengineered strain of Streptomyces spiramyceticus WSJ-1 was constructed by integrating the
Peng-Hu Zhang et al.
Sheng wu gong cheng xue bao = Chinese journal of biotechnology, 23(2), 268-272 (2007-04-28)
The purification and the characteristics of an enzyme from Morganella morganii J-8, which could produce d-pseudoephedrine from 1-phenyl-2-methylamine-acetone, were performed in this study. In this research, first, cells were disrupted by ultrasonic treatment at 4 degrees C. The carbonyl enantioselective
Tatyana A Muranova et al.
Acta crystallographica. Section D, Biological crystallography, 58(Pt 6 Pt 2), 1059-1062 (2002-05-31)
Leucine dehydrogenase is an octameric enzyme which belongs to the superfamily of amino-acid dehydrogenases and catalyses the reversible oxidative deamination of leucine to 2-ketoisocaproate, with the corresponding reduction of the cofactor NAD(+). Catalysis by this enzyme is thought to involve
Nasz zespół naukowców ma doświadczenie we wszystkich obszarach badań, w tym w naukach przyrodniczych, materiałoznawstwie, syntezie chemicznej, chromatografii, analityce i wielu innych dziedzinach.
Skontaktuj się z zespołem ds. pomocy technicznej