Kluczowe dokumenty
CRISPR30
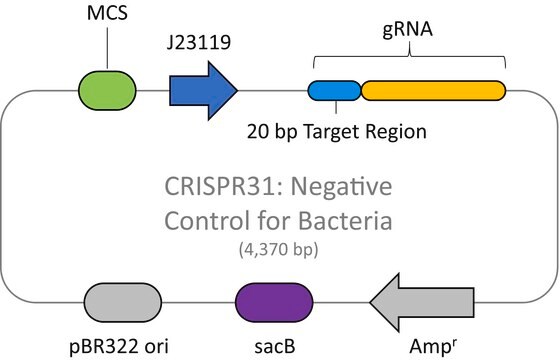
Plazmid kontroli pozytywnej CRISPR LacZ dla bakterii
About This Item
Polecane produkty
Formularz
liquid
opakowanie
vial of 50 μL
stężenie
20 ng/μL in TE buffer; DNA (1μg of purified plasmid DNA)
metody
microbiological culture: suitable
Zastosowanie
CRISPR
genome editing
Promotor
Promoter activity: constitutive
Warunki transportu
dry ice
temp. przechowywania
−20°C
Opis ogólny
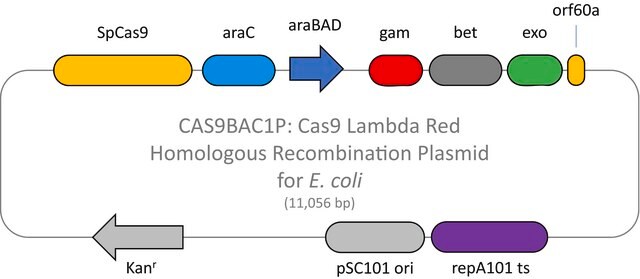
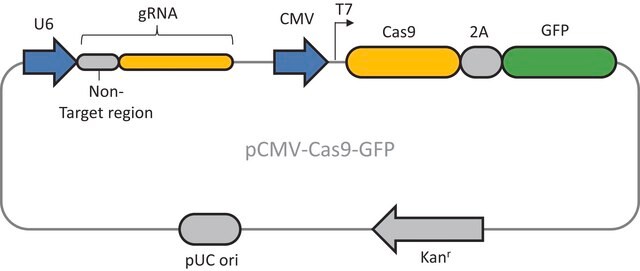
Tutaj przedstawiamy nowatorski system λ-Red z podwójnym wektorem CRISPR/Cas dla ulepszonej rekombinacji w E. coli. Wykazano, że nasz system ułatwia ukierunkowaną homologicznie naprawę DSB utworzonych przez endonukleazę Cas9, umożliwiając zmiany genetyczne poprzez integrację chromosomalną DNA dawcy.
Plazmid ten należy stosować w połączeniu z plazmidem rekombinacji homologicznej Cas9 Lambda Red dla E. coli (CAS9BAC1P) jako kontrolę pozytywną dla niestandardowego eksperymentu edycji genów. Niestandardowe gRNA (CRISPRBACD) można zaprojektować i zamówić za pośrednictwem strony https://www.sigmaaldrich.com/pc/ui/genomics-home/customcrispr
Plazmid CRISPR LacZ Positive Control Plasmid for Bacteria (CRISPR30) zawiera odstęp gRNA ukierunkowany na gen lacZ w dzikim typie E. coli wyrażany konstytutywnie z promotora J23119, marker oporności na ampicylinę, źródło replikacji pBR322 i gen sacB z Bacillus subtilis do utwardzania opartego na kontr-selekcji.
Zastosowanie
- Rekombinacja za pomocą HR do analizy mutacji lub SNP
- Tworzenie linii komórkowych knock-in z promotorami, znacznikami fuzyjnymi lub reporterami zintegrowanymi z endogennymi genami.
- Tworzenie nokautów genów w liniach komórkowych E. coli
Optymalizacja szczepu
Cechy i korzyści
Bez markerów: nie wymaga wstawiania markerów oporności na antybiotyki
Bez blizn: brak sekwencji blizn po wycięciu markera, które często powodują rekombinację poza celem
Multipleksowanie: jednocześnie można używać wielu niestandardowych sekwencji gRNA
Zasada
Informacje prawne
produkt powiązany
Kod klasy składowania
12 - Non Combustible Liquids
Klasa zagrożenia wodnego (WGK)
WGK 2
Temperatura zapłonu (°F)
Not applicable
Temperatura zapłonu (°C)
Not applicable
Wybierz jedną z najnowszych wersji:
Certyfikaty analizy (CoA)
Nie widzisz odpowiedniej wersji?
Jeśli potrzebujesz konkretnej wersji, możesz wyszukać konkretny certyfikat według numeru partii lub serii.
Masz już ten produkt?
Dokumenty związane z niedawno zakupionymi produktami zostały zamieszczone w Bibliotece dokumentów.
Produkty
In this article, we present an application of our novel E. coli CRISPR/Cas-mediated Lambda-Red (λ-Red) homologous recombination (HR) vector system, which facilitates gene editing through the homology-directed repair (HDR) of double-stranded DNA breaks (DSBs) created by Cas9 endonuclease, using either ssDNA or dsDNA as an editing template.
Global Trade Item Number
| SKU | GTIN |
|---|---|
| CRISPR30-1EA | 4061841332459 |
Nasz zespół naukowców ma doświadczenie we wszystkich obszarach badań, w tym w naukach przyrodniczych, materiałoznawstwie, syntezie chemicznej, chromatografii, analityce i wielu innych dziedzinach.
Skontaktuj się z zespołem ds. pomocy technicznej