17-10188
Biosensor LentiBrite RFP-LC3 z kontrolnym mutantem lentiwirusowym
Synonim(y):
Białko związane z mikrotubulami 1A/1B łańcuch lekki 3, białko związane z autofagią LC3, związany z autofagią modyfikator ubikwityny LC3, MAP1A/MAP1B łańcuch lekki 3, białko związane z mikrotubulami 1 łańcuch lekki 3
About This Item
Polecane produkty
Opis ogólny
http://www.nature.com/app_notes/nmeth/2012/121007/pdf/an8620.pdf
(Kliknij tutaj!</A>)
Dowiedz się więcej o zaletach naszych LentiBrite Lentiviral Biosensors! Kliknij tutaj.
Biosensory mogą być wykorzystywane do wykrywania obecności/braku określonego białka, jak również subkomórkowej lokalizacji tego białka w żywej komórce. Znaczniki fluorescencyjne są często pożądane jako środek do wizualizacji interesującego białka w komórce za pomocą mikroskopii fluorescencyjnej lub poklatkowego przechwytywania wideo. Wizualizacja żywych komórek bez zakłóceń pozwala badaczom obserwować warunki komórkowe w czasie rzeczywistym.
Systemy wektorów lentiwirusowych są popularnym narzędziem badawczym wykorzystywanym do wprowadzania produktów genowych do komórek. Transfekcja lentiwirusowa ma przewagę nad metodami niewirusowymi, takimi jak transfekcja chemiczna, w tym wyższą wydajność transfekcji komórek dzielących się i nie dzielących się, długotrwałą stabilną ekspresję transgenu i niską immunogenność.
EMD Millipore wprowadza LentiBrite Lentiviral Biosensors, nowy zestaw wstępnie zapakowanych cząstek lentiwirusowych kodujących ważne i podstawowe białka autofagii, apoptozy i struktury komórkowej do wizualizacji w różnych stanach komórek/chorób w analizie żywych komórek i in vitro.
- Wstępnie zapakowane, znakowane fluorescencyjnie za pomocą GFP i RFP
- Wyższa wydajność transfekcji w porównaniu z tradycyjnymi metodami opartymi na chemikaliach i innymi metodami transfekcji niewirusowej
- Zdolność do transfekcji dzielących się, nie dzielących się i trudnych do transfekcji typów komórek, takich jak komórki pierwotne lub macierzyste
-Brak zakłóceń funkcji komórkowych
Cząsteczki LentiBrite RFP-LC3-G120A firmy EMD Millipore służą jako kontrola negatywna obok RFP-LC3 typu dzikiego (katalog nr 17-10143) do analizy autofagii w żywych komórkach.
Zmutowana forma LC3 z C-końcową glicyną zmienioną na alaninę (LC3-G120A) nie jest w stanie zaakceptować modyfikacji PE i nie przenosi się do autofagosomu po indukcji autofagii.
Cząsteczki LentiBrite RFP-LC3-G120A firmy EMD Millipore służą jako kontrola negatywna obok RFP-LC3 typu dzikiego (nr katalogowy 17-10143) do analizy autofagii w żywych komórkach.
Zastosowanie
(Patrz rysunek 1 w arkuszu danych)
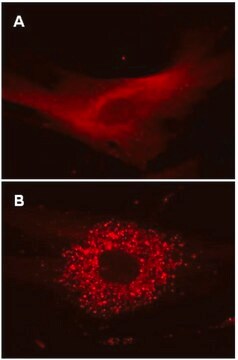
Komórki HT-1080 umieszczono na szkiełku komorowym i transdukowano cząstkami lentiwirusowymi w MOI 20 przez 24 godziny. Po wymianie pożywki i 48 godzinach dalszej inkubacji, komórki pozostawiono w pełnej pożywce lub inkubowano przez 4 godziny w EBSS zawierającym inhibitor lizosomów, aby wywołać autofagię i zahamować lizosomalną degradację autofagosomów. Komórki utrwalono formaldehydem i zamontowano. Obrazy uzyskano za pomocą zanurzeniowej mikroskopii fluorescencyjnej szerokiego pola. Mutant kontrolny RFP-LC3 wykazuje rozproszoną dystrybucję jądrową i cytozolową zarówno w komórkach autofagicznych karmionych, jak i głodzonych (tj. brak translokacji do punktowej dystrybucji cytoplazmatycznej charakterystycznej dla LC3 typu dzikiego).
Porównanie immunocytochemiczne i analiza inhibitorów:
(Patrz rysunek 2 w arkuszu danych)
Podobnie jak na rysunku 1 (patrz arkusz danych), komórki HeLa umieszczono na szkiełku komorowym i transdukowano cząsteczkami lentiwirusowymi w MOI 20 przez 24 godziny. Po wymianie pożywki i dalszej 48-godzinnej inkubacji, komórki pozostawiono w pełnej pożywce, inkubowano przez 4 godziny w EBSS zawierającym inhibitor lizosomów w celu indukcji autofagii i zahamowania degradacji lizosomów lub inkubowano jak w poprzednim przypadku, z dodatkiem 5 mM 3-metyloadeniny (3-MA) jako inhibitora autofagii. 3-MA nie wpływa na lokalizację mutanta kontrolnego RFP-LC3. Barwienie immunocytochemiczne (zielony) tych samych pól widzenia przeciwciałem monoklonalnym przeciwko LC3A ujawnia podobny wzór ekspresji do zmutowanego białka (czerwony) w warunkach żywienia. Barwienie immunologiczne głodzonych komórek wykazuje punktowy rozkład endogennego LC3 typu dzikiego, podczas gdy sygnał po leczeniu 3-MA jest zmniejszony.
Trudne do transfekcji typy komórek:
(Patrz rysunek 3 w arkuszu danych)
Pierwotne typy komórek HUVEC (górny rząd) lub HuMSC (dolny rząd) umieszczono na szkiełkach komorowych i transdukowano cząsteczkami lentiwirusowymi w MOI 40 przez 24 godziny. Późniejsze leczenie komórek pozostawionych w pełnej pożywce lub komórek inkubowanych w EBSS z inhibitorem lizosomów przeprowadzono jak na rysunkach 1A i 1B (patrz arkusz danych).
Aby uzyskać optymalną wizualizację fluorescencji, zaleca się analizę docelowego poziomu ekspresji w ciągu 24-48 godzin po transfekcji/infekcji w celu optymalnej analizy żywych komórek, ponieważ intensywność fluorescencji może z czasem słabnąć, szczególnie w trudnych do transfekcji liniach komórkowych. Zainfekowane komórki można zamrozić po udanej transfekcji/infekcji i rozmrozić w hodowli, aby zachować dodatnią ekspresję fluorescencyjną przez ponad 24-48 godzin. Długość i intensywność ekspresji fluorescencyjnej różni się w zależności od linii komórkowej. W przypadku trudnych do transfekcji linii komórkowych może być wymagane wyższe MOI.
Apoptosis & Cancer
Neuroscience
Apoptosis - Additional
Neurodegenerative Diseases
Komponenty
One vial containing 25 µL of lentiviral particles at a minimum of 3 x 10E8 infectious units (IFU) per mL.
For lot-specific titer information, please see lot specific “Viral Titer” in the product specifications of the datasheet.
Promoter
EF-1 (Elongation Factor-1)
Multiplicty of Infection (MOI)
MOI = Ratio of # of infectious lentiviral particles (IFU) to # of cells being infected.
Typical MOI values for high transduction efficiency and signal intensity are in the range of 20-40. For this target, some cell types may require lower MOIs (e.g., HT-1080, HeLa), while others may require higher MOIs (e.g., human umbilical vein endothelial cells (HUVEC), human mesenchymal stem cells (HuMSC), U2OS).
NOTE: MOI should be titrated and optimized by the end user for each cell type and lentiviral target to achieve desired transduction efficiency and signal intensity.
Jakość
Postać fizyczna
Przechowywanie i stabilność
Lentiwirus jest stabilny przez co najmniej 4 miesiące od daty otrzymania, gdy jest przechowywany w temperaturze -80°C. Po pierwszym rozmrożeniu natychmiast umieścić na lodzie i zamrozić w podwielokrotnościach roboczych w temperaturze -80°C. Zamrożone podwielokrotności mogą być przechowywane przez co najmniej 2 miesiące. Dalsze zamrażanie/rozmrażanie może spowodować zmniejszenie miana wirusa i wydajności transdukcji.
WAŻNA UWAGA DOTYCZĄCA BEZPIECZEŃSTWA
Wektory lentiwirusowe z defektem replikacji, takie jak wektor 3. generacji dostarczony w tym produkcie, nie powodują żadnych chorób u ludzi ani zwierząt. Jednakże, lentiwirusy mogą integrować się z genomem komórki gospodarza i tym samym stwarzać pewne ryzyko mutagenezy insercyjnej. Materiał należy do grupy ryzyka 2 i powinien być obsługiwany pod kontrolą BSL2. Szczegółowe omówienie bezpieczeństwa biologicznego wektorów lentiwirusowych znajduje się w Pauwels, K. et al. (2009). Najnowocześniejsze wektory lentiwirusowe do zastosowań badawczych: Ocena ryzyka i zalecenia dotyczące bezpieczeństwa biologicznego. Curr. Gene Ther. 9: 459-474.
Informacje prawne
Kod klasy składowania
10 - Combustible liquids
Klasa zagrożenia wodnego (WGK)
WGK 2
Certyfikaty analizy (CoA)
Poszukaj Certyfikaty analizy (CoA), wpisując numer partii/serii produktów. Numery serii i partii można znaleźć na etykiecie produktu po słowach „seria” lub „partia”.
Masz już ten produkt?
Dokumenty związane z niedawno zakupionymi produktami zostały zamieszczone w Bibliotece dokumentów.
Produkty
Testy autofagii oparte na komórkach, w tym biosensory lentiwirusowe LC3 GFP/RFP, zestawy do wykrywania autofagii oraz aktywatory i inhibitory autofagii.
High titer lentiviral particles for LC3 variants used for live cell analysis of cellular autophagy.
Nasz zespół naukowców ma doświadczenie we wszystkich obszarach badań, w tym w naukach przyrodniczych, materiałoznawstwie, syntezie chemicznej, chromatografii, analityce i wielu innych dziedzinach.
Skontaktuj się z zespołem ds. pomocy technicznej