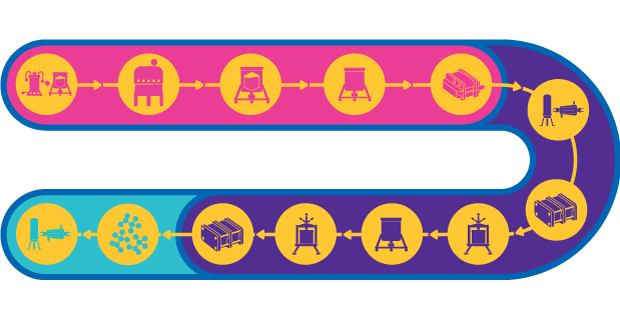
Fabricación de vacunas de partículas similvíricas (VLP)
Las partículas similvíricas (VLP) imitan la estructura general de las partículas víricas, pero no contienen el material genético infeccioso. Cuando se utilizan como vacuna, las VLP provocan una fuerte respuesta inmunógena porque exhiben una gran densidad de epítopos y su capacidad de presentar múltiples proteínas al sistema inmunitario.
La fabricación de VLP implica la expresión celular de la proteína de la envuelta del virus. Las VLP pueden expresarse en diversos sistemas de expresión heteróloga, como el cultivo de células de mamíferos, el sistema de cultivo baculovirus/células de insectos, la fermentación microbiana y las plantas. Las VLP o bien se ensamblan in vivo y esto va seguido de la purificación del lisado celular o bien se obtienen in vitro recuperando la proteína parcialmente ensamblada del lisado celular y montándola en las VLP.
Recursos relacionados
Biopharmaceutical Applications Guide
Artículo técnico: Choosing the optimal cell culture media for vaccine production
Artículo técnico: Choosing the Optimal Vaccine Adjuvant
Artículo: How a Global Network Is Developing a Virus-Like-Particle Vaccine Against Covid-19
Artículo: The Role of the Virus-Like Particle Vaccine Technology in the Evolving Pandemic
Anuncio de prensa: Collaboration with Innovative Biotech to Support Establishment of First Vaccine Production Facility in Nigeria
Seminario virtual: Sf-RVN Cell Line and CD Media Platform: A Production Platform for VLP and AAV
Folleto: Vaccine Bioprocessing Handbook
Minimanual: VLPs Vaccine Bioprocessing
Libro blanco: Sf-RVN® Insect Cell Line for Your Vaccine Processes
Artículo: Nucleic Acid Impurity Reduction in Viral Vaccine Manufacturing
Artículo: Filter-Based Clarification of Viral Vaccines and Vectors
Optimice la productividad y la clarificación de los procesos upstream con un escalado fiable
La plataforma de producción upstream seleccionada para la fabricación de las VLP debe optimizarse para satisfacer los requisitos de productividad. Esta optimización abarca la etapa de clarificación consecutiva a la lisis celular para eliminar células y residuos celulares, y garantiza la recolección masiva de partículas. El proceso upstream sólo tiene éxito, sin embargo, si puede escalarse de forma fiable para satisfacer la demanda prevista del mercado.
Consecución de los objetivos de rendimiento y eficiencia con una potente eliminación de impurezas
Los ácidos nucleicos de las células lisadas son un contaminante común en los procesos de producción de VLP. La Agencia Europea de Medicamentos (EMA) y la Organización Mundial de la Salud (OMS) permiten 10 ng de ADN por dosis para las vacunas de administración por vía parenteral y 100 µg de ADN por dosis para las de administración por vía oral. Además, para minimizar el riesgo de oncogenicidad del ácido nucleico de las células hospedadoras, el tamaño del ADN debe reducirse a una longitud de100–200 pares de bases.
Maximización de la recuperación downstream
Las VLP se purifican comúnmente mediante ultracentrifugación. Aunque este proceso está bien establecido para la producción a pequeña escala, puede llevar mucho tiempo y ser poco escalable. Como alternativa pueden utilizarse métodos de purificación como la cromatografía de intercambio iónico. En ciertos procesos, la adsorción en membrana y la tecnología monolítica pueden proporcionar una capacidad de unión dinámica (DBC) superior que las resinas de partículas. Las resinas multimodales que emplean separación por exclusión de tamaño y basada en la adsorción son otra opción.
Garantía de la seguridad del paciente con esterilización por filtración, formulación y llenado final
Para contribuir a garantizar la seguridad del paciente, las VLP finales producidas deben esterilizarse mediante filtración utilizando un filtro de 0,22 µm. La formulación de las vacunas de VLP puede lograrse utilizando componentes de un solo uso; pueden conectarse bolsas de un solo uso que contienen reactivos de formulación a cualquier mezcladora mediante conexiones rápidas estériles. Después de su composición y formulación, el producto puede transferirse asépticamente a sistemas de llenado de un solo uso para el llenado final y el envasado en viales.

Cultivo celular upstream
Maximice la productividad upstream de VLP y garantice una sólida escalabilidad con:
Tratamiento y clarificación de nucleasas
Consiga el rendimiento deseado de las VLP y la eficiencia del proceso al tiempo que garantiza una depuración potente de impurezas con:
- Tratamiento con nucleasas Benzonase® adecuado para la producción biofarmacéutica EMPROVE® bio
- Detección de Benzonase® con el kit Elisa Benzonase® II para detectar la endonucleasa Benzonase® que queda en el proceso
- Clarificación primaria/secundaria con filtros de profundidad Millistak+® HC POD
- Clarificación primaria con filtros de profundidad Clarisolve®
- Clarificación secundaria con cartuchos Polysep II

Donwstream - Filtración de flujo tangencial
Consiga los objetivos de rendimiento, eficiencia y recuperación de virus al tiempo que garantiza una eliminación sólida de impurezas con:
Downstream - Cromatografía
- Cromatografía en membrana con resina Eshmuno® Q
- Cromatografía en membrana con membranas para cromatografía Natrix® Q Recon Mini
- Cromatografía en membrana con membrana para cromatografía Natrix® Q Pilot
- Cromatografía de captura y/o purificación con resinas para cromatografía Fractogel® EMD DEAE
- Cromatografía de captura y/o purificación con resinas para cromatografía Fractogel® EMD DMAE

Productos químicos de procesos y formulación
Esterilización mediante filtración y llenado final
Garantía de la seguridad del paciente con esterilización por filtración fiable y potente, formulación y llenado final.
- Esterilización mediante filtración y llenado final
- Filtros Durapore® de 0,22 µm
- Filtros Millipore Express® SHF (estériles, de flujo elevado)
- Muestreo estéril con disoluciones para muestreo estéril Novaseptum® Go
- Llenado y acabado con soluciones de un solo uso Mobius® para llenado y acabado
- Estrategias para esterilización mediante filtración
- Estrategias de llenado final

Servicios de validación y análisis
Nuestros servicios de análisis BioReliance® ofrecen excepcionales soluciones de mitigación de riesgos para ayudarle a comercializar con mayor rapidez medicamentos que cambian la vida.
Para seguir leyendo, inicie sesión o cree una cuenta.
¿No tiene una cuenta?