Fabricación de vacunas basadas en virus
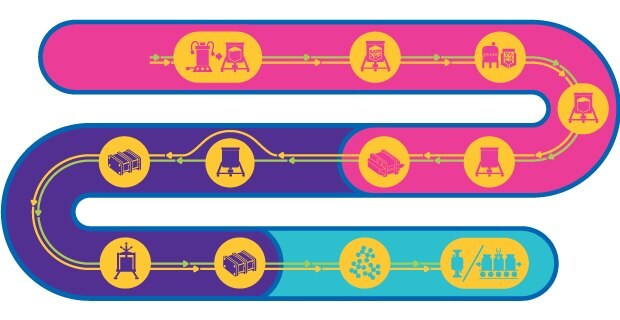
Tren de procesos para virus inactivados y vivos atenuados
Las vacunas basadas en virus consisten en virus atenuados o inactivados. Estas vacunas pueden activar todas las fases del sistema inmunitario y ofrecer una inmunidad rápida y duradera a largo plazo al desencadenar la producción de anticuerpos neutralizantes contra el patógeno específico.
El proceso de fabricación de vacunas basadas en virus atenuados es complejo, consta de varias etapas y debe mantener el potencial infectante del virus atenuado. Si bien hay un procedimiento de trabajo general para la producción, no existe un modelo de fabricación. En cambio, cada proceso debe adaptarse en función de la forma, el tamaño, la naturaleza, el comportamiento fisicoquímico, la estabilidad, y la especificidad de huésped del virus.
Recursos relacionados
Biopharmaceutical Applications Guide
Folleto: Vaccine Bioprocessing Handbook
Minimanual: Cell-Based Vaccine Bioprocessing
Folleto: Enabling Solutions for Vaccines and Viral Therapies
Libro blanco: Filtration Strategies for Optimal Development and Purification of a Foot and Mouth Disease Virus
Libro blanco: Downstream Process Intensification for Virus Purification Using Membrane Chromatography
Nota de aplicación: Effect of Benzonase® Endonuclease Addition to Purification of Sabin Polio Virus Type 3
Artículo técnico: Choosing the Optimal Cell Culture Media for Vaccine Production
Artículo técnico: Choosing the Optimal Vaccine Adjuvant
Artículo: Nucleic Acid Impurity Reduction in Viral Vaccine Manufacturing
Artículo: Filter-Based Clarification of Viral Vaccines and Vectors
Optimice la productividad y la clarificación de los procesos upstream con un escalado fiable
Los procesos de cultivo upstream desarrollados para la fabricación de vacunas basadas en virus deben optimizarse para satisfacer los requisitos de productividad. Esta optimización incluye la etapa de clarificación que es esencial para la eliminación de células y residuos celulares y para garantizar una densa recolección de virus. El proceso upstream sólo tiene éxito, sin embargo, si puede escalarse de forma fiable para satisfacer la demanda prevista del mercado.
Consecución de los objetivos de rendimiento y eficiencia con una potente depuración de impurezas
Los ácidos nucleicos de las células lisadas son un contaminante común en los procesos de producción de vacunas basadas en virus. La normativa exige que la concentración de ácidos nucleicos de la célula huésped arrastrados sea inferior a 10 ng/dosis de la vacuna de virus atenuado. El tratamiento con endonucleasas Benzonase® seguido de filtración de flujo tangencial es una combinación sólida y potente para degradar y luego eliminar los componentes de ácidos nucleicos residuales.
Maximización de la recuperación downstream
El tratamiento con endonucleasa Benzonase® es suficiente para alcanzar el nivel de pureza deseado para la mayoría de las vacunas basadas en virus durante la concentración y la diafiltración. Sin embargo, se requiere cromatografía para alcanzar los objetivos de pureza de las vacunas basadas en virus de última generación, como el virus de la encefalitis japonesa (JEV) y el virus del dengue (DENV). Dado que cada proceso de fabricación debe adaptarse a las características del virus, es esencial disponer de un conjunto de recursos para la purificación downstream con el objetivo de conseguir la pureza deseada y garantizar al mismo tiempo una recuperación óptima.
Garantía de la seguridad del paciente
Si bien las vacunas basadas en virus se fabrican utilizando virus atenuados, garantizar la seguridad de los pacientes sigue siendo una preocupación importante. La masa final de la vacuna antivírica es comparable al del agua. Como tal, la vacuna puede esterilizarse utilizando una filtración esterilizante de 0,22 µm antes de la formulación final y los pasos de llenado final.
Procedimiento de trabajo
Tratamiento con nucleasas y clarificación
Garantizar una sólida escalabilidad
- Nuclease treatment with Benzonase® suitable for biopharmaceutical production EMPROVE® bio
- Benzonase® Detection with Benzonase® Elisa Kit II to detect left over Benzonase® endonuclease in the process
- Primary/Secondary Clarification with Millistak+® HC POD Depth Filters
- Primary Clarification with Clarisolve® Depth Filters
- Secondary Clarification with Polysep II cartridges

Disoluciones tampón y medios para cultivo celular líquido en bioprocesos
Ofrecemos las capacidades de esterilización de líquidos mediante filtración de la mayor calidad del sector, suministrando medios de cultivo celular, tampones y productos CIP y SIP listos para usar de instalaciones GMP de todo el mundo para optimizar su producción biofarmacéutica.

Donwstream - Filtración de flujo tangencial
Consiga los objetivos de rendimiento, eficiencia y recuperación de virus al tiempo que garantiza una potente depuración de las impurezas
Cromatografía downstream
- Membrane Chromatography with Eshmuno® Q Resin
- Membrane Chromatography with Natrix® Q Recon Mini Chromatography Membranes
- Membrane Chromatography with Natrix® Q Pilot Chromatography Membrane
- Capture an/or Polishing Chromatography with Fractogel® EMD DEAE Chromatography Resins
- Capture an/or Polishing Chromatography with Fractogel® EMD DMAE Chromatography Resins

Productos químicos de procesos y formulación
Esterilización mediante filtración y llenado final
Elimine los problemas de contaminación entre productos a la vez que optimiza los requisitos de llenado y acabado y cumple los requisitos normativos actuales

Para seguir leyendo, inicie sesión o cree una cuenta.
¿No tiene una cuenta?

