- mRNAワクチンはどのように免疫を誘導するのか
- ワクチンモダリティとしてのmRNAの利点
- mRNA合成のためのプラスミドDNA(pDNA)の調製
- mRNAのIn Vitro転写・キャップ付加
- In Vitro転写(IVT)用のmRNA合成試薬
- mRNAの精製・分析
- mRNA合成中のdsRNA除去合成mRNAの精製・分析用試薬
The potential for synthetic mRNA to recapitulate the function of mature mRNA has elevated its potential for a spectrum of biopharmaceutical applications. These therapeutics include 合成mRNAは成熟mRNAが有する機能を再現できるため、バイオ医薬品へのさまざまな応用が検討されています。このような治療法には、mRNAのin vivoデリバリーによるタンパク質の代替、幹細胞誘導、またはがん免疫療法があります。最近の重要な医薬品用途として、感染症に対するワクチンの新しいアプローチが挙げられます。最も注目すべきは新型コロナウイルス感染症(SARS-CoV-2)を予防するmRNAベースのワクチンです。
全ワクチン製品およびソリューションについては、ワクチン開発・製造のページをご覧ください。
メッセンジャーRNA(mRNA)ベースのワクチンは、「mRNAはタンパク質をコードする」というセントラルドグマから導かれたものです。この単純明快なワクチンモダリティでは、抗原となるタンパク質全体または一部をコードする遺伝子要素を、翻訳できる状態の分子として投与することにより、免疫応答を誘導します。標的抗原タンパク質をコードするmRNAは、抗原提示細胞に取り込まれ、標的病原体タンパク質に翻訳され、免疫応答を誘導します。このアプローチは、ウイルスが細胞に感染する自然のプロセスをそっくりまねています。
Generally, mRNA vaccines are produced by 一般的に、mRNAワクチンは、in vitro合成により、酵素過程を経て製造されます。mRNAワクチンの開発および製造は、従来のモダリティと比べると、比較的シンプルなプロセスであり、短期間で達成可能です。このような特性はワクチンの開発とスケールアップの促進に適しており、公衆衛生上の差し迫った状況において重大な意味を持つことが現在証明されています。コールドチェーン輸送が不要となるように、mRNAワクチンのデザインと製剤設計に熱安定性を強化する技術革新が生まれると、生産コストを削減でき、世界中でワクチンを入手しやすくなると考えられます。
For mRNA-based vaccine design, mRNAベースのワクチンをデザインするとき、一般的には、鋳型となるプラスミドDNA(pDNA)のin vitro転写を利用して、機能を有する合成mRNAを製造します。プラスミドベクターには、通常、次のような要素が含まれています。すなわち、T7、SP6またはT3 RNAポリメラーゼ(これらはすべてバクテリオファージに由来する)にのみ認識される上流プロモーター、5' UTR、cDNA、3' UTR、下流poly (A) tail、およびそのpoly (A) tailの下流に位置する固有の切断部位です。

図1.In vitro転写(IVT)用のプラスミド生成。遺伝子合成後、標的DNAのクローニングにプラスミドベクター(pDNA)を使用。pDNAは細菌培養で増殖し、シリカメンブレンを用いたスピンカラムなどの核酸精製法を用いて精製。
mRNAのIN VITRO転写・キャップ付加
通常、バクテリオファージのRNAポリメラーゼを使用して、直線化されたプラスミドDNAを転写します。まず、pDNAを、選定した固有の制限酵素を用いて直線化します。切断後に、直線化したpDNAをフェノール‐クロロホルム法またはGenElute™ PCR Clean-Up Kitのような方法で精製する場合もあります。容易にスケールアップできるという理由で、多くの場合、大規模精製にはタンジェンシャルフローフィルトレーション(TFF)が望ましいとされます。直線化後、組換え型RNAポリメラーゼ(T7、T3またはSP6)とヌクレオシド三リン酸の混合溶液にCleanCap® 試薬またはARCA(Anti-Reverse Cap Analog)のようなキャップアナログを加えて、in vitro転写とキャップ付加を行います。自然免疫系を抑制するために、GTPの代わりに、N1-Methylpseudouridine-5'-Triphosphate(N1-Methylpseudo-UTP、1-Methylpseudo-UTP)のような修飾ヌクレオシドを用いることもできます。最新のmRNAワクチンではそのような修飾ヌクレオシドが使用されています。 GTPと競合するため、ARCAによるmRNAのキャップ付加効率は平均70%~80%であり、mRNAの収量は、標準的なmRNA合成と比較して約4分の1に減少します。 対照的に、CleanCap®試薬は、mRNAの産生収量に影響することなく、キャップ付加効率94%で機能することが示されています。別法として、キャップアナログを使用せずに、代わりにワクシニアウイルスにコードされたキャップ付加複合体[キャップ付加酵素、2'-O-メチルトランスフェラーゼ、GTP、およびS-アデノシルメチオニン(SAM)]を用いて転写を行うことでもキャップを付加できます。キャップ付加効率は対象のmRNAの二次構造に左右されます。最後に、鋳型pDNAのpoly (A) tailの長さが不十分な(最長で150塩基まで)場合、poly (A)酵素を使用して延長することができます。
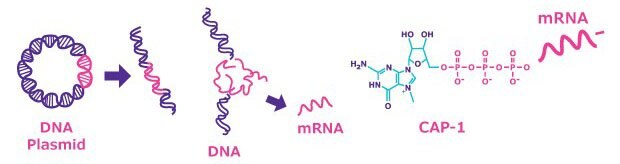
図2.mRNAは、pDNAの直線化、無細胞系の方法によるmRNAのin vitro転写(IVT)、キャップアナログまたはウイルスにコードされたキャップ付加複合体を用いたmRNAへのキャップ付加により合成される
mRNAの精製・分析
mRNA精製の最初のステップは、直線化した鋳型pDNAをDNA分解酵素(deoxyribonuclease :DNase)を用いて取り除くことです。次に、塩化リチウム(LiCl)を用いてmRNAを沈殿させ、75%エタノールで洗浄します。得られたmRNAペレットは水または再懸濁用バッファーに再懸濁することができます。しかし、この沈殿法のスケールアップはやや困難であり、GMP製造下において有害な溶媒の使用は避けるべきであるという理由から、この方法はスケールアップの際には使用すべきではありません。小規模な精製ではGenElute™ mRNA Miniprep Kitが推奨されます。 規模拡大時には、Pellicon®カセットを利用してタンジェンシャルフローフィルトレーション(TFF)を実施することができ、また比例してスケールアップすることができます。
Double-stranded RNA or dsRNA, a transcriptional by-product, is a major concomitant of mRNA synthesis. The dsRNA can stimulate innate immune responses that act to reduce the translation of delivered mRNA. When mRNA is synthesized for vaccine development, dsRNA should therefore be removed. Cellulose-based purification using 転写副産物である二本鎖RNA(dsRNA)はmRNA合成の主要な付随物です。dsRNAは、投与されたmRNAの翻訳を低下させる作用のある自然免疫応答を刺激する可能性があります。したがって、ワクチン開発のためにmRNAを合成する場合、dsRNAは除去すべきです。セルロースファイバーを使用するセルロースベースの精製は、さまざまな製造スケールでdsRNA除去に利用できます。
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?