mRNAワクチン・mRNA治療薬の製造戦略
Laurens Vergauwen, Process Development Scientist, Nargisse El Hajjami, Associate Director Cell and Gene Therapy Segment, Manuel Brantner, Associate Director Vaccine and Plasma Segment, Shiksha Mantri, Global Marketing Manager mRNA Applications, Bahar Cebi, Segment Marketing Manager Novel Modalities & Vaccines
Merck
アデノ随伴ウイルス(AAV)ベクターのような十分に確立されているウイルス性デリバリーシステムは、ベクターによって免疫原性を獲得するワクチンおよび遺伝子治療としての使用が認められています。ウイルス性デリバリーシステムは、広く使用されているものの、免疫原性を生じさせる可能性があり、他の様式と比べて高頻度で全身性の副作用を引き起こす可能性があります。さらに、製造工程が複雑になる場合があり、遺伝子治療の用途では高いウイルス価を必要とします。
これに対し、非ウイルス性デリバリーシステムの安全性プロファイルはより良好であると考えられ、製造を簡素化して、プロセスをテンプレート化できる可能性があります。
mRNA技術は非ウイルス性のデリバリーシステムを使用しており、多様な用途に利用できます。mRNAが細胞の細胞質ゾルにデリバリーされると標的タンパク質の産生が誘導されます。産生されたタンパク質は、治療薬または予防薬として作用したり、ワクチン接種の目的である免疫応答を引き起こす抗原として機能したり、欠陥のあるタンパク質の代替として機能したり、抗腫瘍反応を活性化したりすることができます。
Strong early results for three mRNA vaccines against SARS-CoV-2 have implications that go far beyond the current pandemic and bode well for similar approaches in the fight against cancer, heart disease and other infectious diseases.新型コロナウイルス(SARS-CoV-2)に対する3種のmRNAワクチンにより好調な初期成績が得られていることは、現在のパンデミックだけにとどまらず、がん、心疾患および他の感染症に対する同様のアプローチにとっても幸先が良いものです。
mRNA製造に関する考慮事項
治療薬およびワクチンのためのmRNAの開発と製造は、比較的シンプルで拡張性があり、極めて迅速に行うことができます(図1)。mRNA技術は、開発から臨床試験および承認までの期間を短縮できるため、感染症の大流行およびパンデミックへの対策のみならず、アンメットニーズのある疾患の新規治療法の開発にとっても魅力的です。
mRNAは酵素を用いたプロセスによるin vitro合成により製造されます。これは、従来のin vivoタンパク質発現が、時間のかかるクローニングおよび増幅ステップを必要とするのとは対照的です。 in vitro 合成プロセスが使用されるため、細胞または宿主細胞タンパク質を除去する必要がありません。このように製造工程が簡略化されおり、対象が何であれ、同じ反応材料および容器を使用できるため、GMP施設は非常に短期間で、工程と製剤化への適応を最小限にしながら、新たな標的タンパク質をコードするmRNAの製造に切り替えることができます。
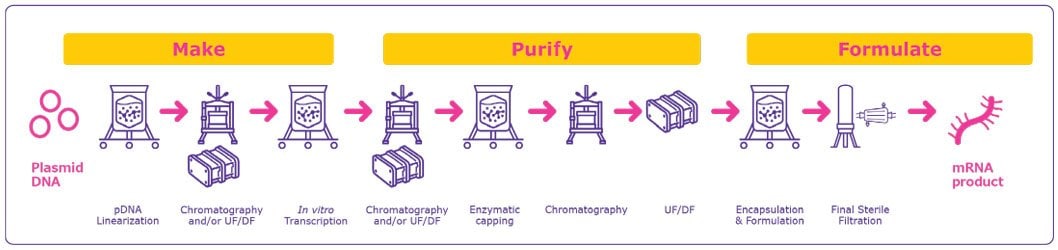
図1.一般的なmRNA製造工程の概要
mRNAの作製
mRNAベースの治療薬およびワクチンを製造する 際の出発材料は、通常または一般的にはpDNA鋳型であり、pDNA鋳型にはDNA依存性RNAポリメラーゼプロモーターおよび対象のmRNAコンストラクトに対応する配列が含まれます。中心的な役割を果たすのはpDNAコンストラクトであるため、そのデザインおよび純度は、生成するmRNAの最適化にとって重要な要素です。核酸のサイズが大きく、粘性が高く、せん断の影響を受けやすいほか、pDNAと不純物が類似することから、pDNAの作製および精製にはいくつかの課題があります。これらの課題を克服するための戦略については、ウェビナー「Scalable purification of Plasmid DNA」で述べています。
mRNAコンストラクトは、対象遺伝子の効率的な発現を目的として設計されます。安定性、遺伝子発現および効率的なタンパク質の翻訳は、いくつかの構造要素により左右されます(図2):
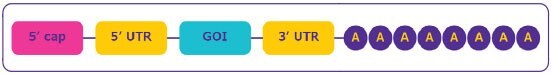
図2.mRNAの構造
- mRNA配列の5’末端にあるキャップ領域は、mRNAの成熟に不可欠であり、リボソームがmRNAを認識しタンパク質を効率的に翻訳できるようにします。また、キャップ領域は、mRNAをヌクレアーゼによる分解から保護することにより、mRNAを安定化します。
- mRNAコード領域の上流と下流のドメインに位置する非翻訳領域(UTR)は、mRNAの翻訳効率、局在化および安定性に影響を与えるものであり、効率的なタンパク質発現に利用できます。
- オープンリーディングフレームすなわちコード配列領域には、対象の遺伝子(GOI)が含まれます。
- The poly-(A) tail is crucial for protein translation and mRNA stability by preventing digestion by 3’ exonuclease.Poly (A) tailは、タンパク質の翻訳と、3’エキソヌクレアーゼによる分解から保護したmRNAの安定性にとって不可欠です。
The required pDNA is amplified within bacterial cells, typically 必要なpDNAは、細菌細胞(通常は大腸菌)内で増幅されます。その後、精製ステップを経て、高純度で濃縮された環状pDNAが得られます。得られたpDNAは直線化され、RNAポリメラーゼの鋳型として標的mRNAの転写に使用されます。Linearization is required to avoid transcriptional readthrough events that may generate undesired forms of mRNAs leading to additional impurities that would need to be removed. Linearization is achieved by mixing the plasmid DNA with a restriction enzyme in a reaction buffer直線化は、転写時の読み飛ばし(リードスルー)を回避するために必要です。読み飛ばしが起こると、非標的mRNAが生成され、除去が必要な不純物が増加する可能性があります。pDNAを制限酵素と反応バッファー4内で混合後、37℃で4時間インキュベーションすると、直線化されます。必要に応じて、EDTA添加または65℃での熱不活化により、反応を停止させます。Impurities such as the restriction enzyme, BSA, DNA fragments, endotoxins and others are then removed. Most of the lab scale processes use a solvent extraction technique and this not applicable for GMP production environments.その後、制限酵素、BSA、DNA断片、エンドトキシンなどの不純物を除去します。ラボスケールのプロセスの大部分で、溶媒抽出法が使用されますが、溶媒抽出法はGMP製造環境には適用できません。 この精製ステップでは、代わりに、タンジェンシャルフローフィルトレーション(TFF)およびクロマトグラフィーを用いて不純物を効率的に除去できます。次のステップは in vitro 転写であり、直線化したpDNAが鋳型DNAとしてmRNAに転写されます。この酵素反応では、RNAポリメラーゼ、ヌクレオチド三リン酸など天然の転写プロセスに必要な要素を使用します。転写後の最終的なmRNA構造は、その安定性および細胞への効率的な導入のため、5’キャップ構造を必要とします。キャップは、2種類の方法、すなわち、共転写または酵素による方法で付加できます。共転写によるキャップ付加は、通常、キャップアナログおよびグアノシン三リン酸(GTP)を4:1の比率で混合した転写ミックスを添加することにより行うことができます。37℃での反応ステップの後、一般的には、DNaseの添加により鋳型DNAを分解します。分解により生じた低分子量のDNA断片は、より分子量の大きいmRNA分子から、タンジェンシャルフローフィルトレーション(TFF)によって容易に分離できます。鋳型DNA除去の別の選択肢としてクロムステップ[poly (dT)キャプチャーなど]の利用もあります。 後者の場合、鋳型DNAを分解する必要がなく、低分子量のDNA断片がmRNAにハイブリダイズするリスクを回避できます。4共転写によるキャップ付加は、転写ステップ中に同じ反応混合液で行うことができるため、酵素によるキャップ付加と比較して低コストかつ迅速です。しかし、GTPはキャップアナログではなくmRNA配列に結合する可能性があるため、効率および収量が低くなり、キャップが付加されていない不純物が生成されることがあります。さらに、キャップアナログは逆方向に付加されることがあります。この点を克服するべく、5’キャップが逆方向に付加されることを阻止し、翻訳効率を向上させることを目的として、anti-reverse cap analog(ARCA)が開発されています。酵素によるキャップ付加は、in vitro転写混合物からmRNAを精製した後に行われます。この反応では通常、ワクシニアウイルス由来のキャップ付加酵素を用いて、mRNA構造にキャップ構造を付加します。酵素によるキャップ付加は、キャップ付加効率が極めて高いですが、共転写によるキャップ付加よりも高コストであり、より多くの操作を必要とします。mRNAの精製in vitro転写ステップの後、不純物およびエンドトキシン、免疫原性のある二本鎖 RNA(dsRNA)、残存する鋳型DNA、RNA ポリメラーゼ、元素不純物などを含有する先行工程で使用した材料からmRNAを精製します。mRNA精製にはいくつかの選択肢があります。TFFは、mRNAのサイズに基づいて30〜300kDaの範囲の分子量カットオフによって保持されない小さな不純物からmRNAを効率的に分離できます。TFFを使用すると、同じ操作で対象物質の精製、濃縮およびダイアフィルトレーションが可能です。この段階では、mRNAは酵素によるキャップ付加またはクロマトグラフィーに適したバッファーに溶解されている必要があります。しかし、TFFを使用する際に考慮すべき重要な点は、低分子のDNA断片がmRNAとハイブリダイズし、新たな不純物を生成する可能性があることです。前述のとおり、鋳型DNAを除去するキャプチャーを使用すれば、このようなリスクを回避できます。5TFFの代わりに、いくつかのクロマトグラフィー法、具体的には、逆相イオン対クロマトグラフィー、陰イオン交換クロマトグラフィー、poly (dT)をキャプチャー用分子として用いるアフィニティークロマトグラフィーなどを使用することができます(表1)。

表1.逆相イオン対、陰イオン交換およびアフィニティークロマトグラフィーによるmRNA精製の比較。DBC:動的結合容量。3,4
クロマトグラフィーにより鋳型DNAを効率的に除去することで、限外ろ過/ダイアフィルトレーション中にハイブリダイゼーションが発生するリスクを排除します。しかし、クロマトグラフィーは高コストで、培地交換や後続ステップのための前処理として、TFFが依然として必要です。
クロマトグラフィーは、酵素によるキャップ付加のステップ後にも、前段階の酵素反応ステップで生成される不要な物質やオリゴヌクレオチド不純物の除去に使用されます。
逆相イオン対クロマトグラフィーは、一般に小規模生産に使用されます。この手法は、極めて効率的かつ迅速にRNAを精製でき、DNA、二本鎖RNA(dsRNA)および短い転写産物から一本鎖RNA(ssRNA)を良好に分離できます。ただし、溶媒を使用するため、GMP製造設備での生産には向いていません。また、この手法はイオン対試薬を必要とし、mRNAとの複合体が形成されるため、その除去に大量のダイアフィルトレーションが必要となる場合があります。さらに、タンパク質や凝集体によるファウリングが生じやすいため、キャプチャーよりもポリッシングに適しています。
Anion exchange has a high dynamic binding capacity and is very efficient for removing immunogenic impurities such as dsRNA, uncapped RNA, RNA–DNA hybrids and other RNA structures. While this allows the use of aqueous solutions, it might require the addition of chaotropic agents that can be toxic and operation at temperatures of up to 85°C to desorb large mRNA molecules bound to the resin. Ambient temperature operations typically elute mRNA species smaller than 500 bases.陰イオン交換クロマトグラフィーは、動的結合容量が大きく、免疫原性のある不純物(dsRNA、キャップ付加されていないRNA、RNA-DNAハイブリッド、その他のRNA構造など)を極めて高い効率で除去できます。 この手法では水溶液を使用できますが、レジンに結合した高分子量のmRNAを脱着させるために、毒性のあるカオトロピック剤の使用や最高85°C までの昇温が必要となる場合があります。常温での操作で溶出するのは通常、500塩基未満のmRNA種です。3
Affinity chromatography poly(dT) capture uses a resin to specifically capture the poly(A) tail of full-length mRNA transcripts. This process efficiently removes DNA, nucleotides, enzymes, buffer components and any other impurities not having a poly(A) tail.Poly (dT)をキャプチャー用分子として用いるアフィニティークロマトグラフィーには、完全長mRNA転写産物のpoly (A) tailを特異的にキャプチャーするレジンを使用します。このプロセスにより、DNA、ヌクレオチド、酵素、バッファー成分およびpoly (A) tailを持たないその他のあらゆる不純物が効率的に除去されます。
The downside of this technique is that, unlike reversed phase and anion exchange, it cannot discriminate dsRNA from ssRNA. In addition, product-related poly(dT) is not efficient for removing other product-related impurities such as DNA fragments that have hybridized to the mRNA. For this reason, the initial chromatography step is Affinity Chromatography typically followed by a second chromatography step using anion exchange for polishing purposes.この手法の短所は、逆相クロマトグラフィーおよび陰イオン交換クロマトグラフィーと異なり、dsRNAとssRNAを区別できないことです。さらに、対象物質のpoly (dT)は、mRNAとハイブリダイズしたDNA断片などのその他の関連不純物の除去に対して効率的ではありません。 このため、最初のクロマトグラフィーステップはアフィニティークロマトグラフィーですが、それに続いて、通常ポリッシングのため、2つ目の陰イオン交換クロマトグラフィーのステップが続きます。
Following the chromatography step(s), a final concentration and diafiltration is performed to maximize product purity and transfer the mRNA into the appropriate buffer for formulation or storage. At this stage, mRNA can be further purified, concentrated and diafiltered within the same unit operation. A sterile filtration step can be performed following this TFF step. It should be noted, however, that sterilizing grade filtration of some mRNAs with a molecular weight of 5000 kDa or higher can be challenging.クロマトグラフィーの各ステップに続き、最終濃縮とダイアフィルトレーションを実行します。これは製剤純度を最大限に高めて、製剤用または保存用の適切なバッファーにmRNAを移すのが目的です。この段階では、同じ操作でmRNAの精製、濃縮およびダイアフィルトレーションが可能です。このTFFステップの後に滅菌ろ過ステップを実行できます。ただし、注意すべき点として、分子量が5000 kDa以上の一部のmRNAについては、滅菌グレードでろ過することが難しい場合があります。
mRNAの製剤化
デリバリーツールはmRNAワクチン・mRNA治療薬の有効性という点でも同様に重要です。最終のmRNA精製ステップの次に考慮すべき事項は、デリバリーのメカニズムです(図3)。最先端のデリバリーシステムの1つは、脂質およびポリマーとの結合体です。これらのデリバリーシステムには、オリゴヌクレオチドと脂質との結合により形成される複合体(リポプレックス)や、ポリエチレンイミン(PEI)などの正電荷ポリマーとの結合により形成される複合体(ポリプレックス)などがあります。
mRNAデリバリーに最もよく使用されているのは、脂質ナノ粒子(LNP)です。各脂質ナノ粒子はそれぞれ4つの異なる脂質から構成され、mRNAを運搬し、分解から保護します。
静電気的相互作用によるRNA内封には、カチオン性/イオン化可能 脂質が必要です。肝細胞へのデリバリー(タンパク質発現の刺激またはサイレンシングを目的とする)にはイオン化可能脂質(受動的ターゲティング、エンドソームからの放出)が必要ですが、免疫細胞による取り込みははるかに容易です 。免疫細胞による取り込みは、強カチオン性脂質でも機能します

図3.複数のmRNAデリバリーシステムが利用可能
これらの脂質は、細胞質への効率的なRNA放出も担います。カチオン性脂質の構造は、LNPの活性、毒性および生体内分布に大きな影響を与え、ひいては、体内での潜在的な毒性作用に影響を及ぼします。
ポリエチレングリコール(PEG)脂質 は、コロイド安定性をもたらし、粒子へのタンパク質の結合を阻止することにより、粒子を免疫系から保護し、血中滞留性を高めます。PEG鎖および脂肪酸鎖の長さは、血中滞留性および膜融合性、すなわち粒子とLNPのエンドソーム膜との融合の程度を決定づけます。血中滞留性を高めるためには、ポリエチレングリコールジステアロイルグリセロール(DSG PEG 2000)などの長い脂肪酸鎖を使用することもできます。 PEGの濃度も粒子サイズに影響を与えます。また、PEGを使用するとPEGに対する抗体が形成され、mRNA投与による免疫付与が役に立たなくなる可能性もあります。
中性/アニオン性脂質 は、構造的安定性をもたらし、膜融合性および生体内分布を決定づける役割を担います。1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミンの例を挙げます。最近の研究1 では、エンドソーム放出に重要な役割を果たす1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン(DOPE)を含むLNPは、1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン(DSPC)を含むLNPと比較して、肝臓へのmRNAデリバリー性が高いことが示されました。これらのヘルパー脂質は、RNAの安定的な内封にも役立つことが、最近の複数の研究2 から示唆されています。
コレステロール は、LNPの二重膜の密度、流動性および取り込み(ラフト形成)の調整に使用されます。動物由来および合成コレステロールには市販品がありますが、合成コレステロールには、高純度、プリオンなどの動物由来分子を含有しない、大量生産が可能、品質の均一性が高いなどいくつかの利点があります。
脂質を選択する際の考慮事項 最大の効果と最適な生体内分布が得られるデリバリー経路を考慮し、それに基づいて脂質を選択する必要があります。脂質の選択に加えて、個々の脂質間の比率も、二重膜の流動性およびLNPの膜融合性に直接影響を与えるため、微調整を行う上で重要な要素です。
Several critical aspects must be considered when selecting the lipid. Lipid type, source and quality have a direct impact on the impurity profile and properties such as the particle characteristics, stability and release profile is the final formulation. To achieve reproducible results with the final formulation, consistent quality of lipids is required, which is dependent on the quality of the raw materials used to synthesize the lipids and appropriate material characteristics of the lipid itself.脂質を選択する際には、いくつかの極めて重要な側面を考慮しなければなりません。脂質の種類、由来および品質は、最終処方の製剤の不純物プロファイルおよび特性(粒子の特徴、安定性、放出プロファイルなど)に直接影響を与えます。最終処方の製剤で再現性の高い結果を得るためには、脂質の品質が均一である必要があります。脂質の品質の均一性は、脂質の合成に使用される原材料の品質および脂質自体の適切な材料特性に左右されます。
The purified mRNA can be formulated into the delivery particle via different techniques. In the commonly used solvent injection technique, lipids are dissolved in a solvent such as ethanol and rapidly mixed in an aqueous, low pH buffer containing the mRNA using a crossflow mixing or microfluidic mixing is to create the LNPs. The low pH buffer is then diafiltered into a neutral buffer and ultrafiltration is used to concentrate the particles.精製されたmRNAは、さまざまな方法によってデリバリー粒子に内封できます。一般的に使用される溶媒注入法では、脂質をエタノールなどの溶媒に溶解した後、クロスフロー混合またはマイクロ流体混合を用いて、mRNAを含有する低pHの水性バッファーと速やかに混合し、LNPを作製します。その後、低pHバッファーを中性バッファー中にダイアフィルトレーションし、限外ろ過により粒子を濃縮します。The TFF step must be rapid as lipids can be hydrolyzed at low pH, leading to formation of impurities such as hydrolipids that can affect the lipid bilayer structure, stability of the formulation and drug release characteristics. Degradation of the lipids can also increase the size of the particle, resulting in aggregation.脂質が低pHで加水分解されると、脂質二重膜構造、製剤の安定性や、薬物放出性に影響を及ぼしうるハイドロリピッドなどの不純物が生成する可能性があるため、TFFステップは迅速に実行しなければなりません。脂質が分解されると、粒子サイズが大きくなり、凝集する可能性もあります。LNPs have a very good stability, structural plasticity and enhanced gene delivery compared to other delivery systems. They increase the transfection rate compared to naked mRNA, allow for intravenous injection without the risk of being degraded by RNases present in the bloodstream and enable active targeting if specific ligands are incorporated.LNPは安定性が極めて高く、構造的柔軟性に優れ、他のデリバリーシステムよりも高い遺伝子デリバリー効率を有します。LNPを利用すると、裸のmRNAを用いるよりも遺伝子導入率が高まり、静脈注射をしても血流中のRNaseにより分解されるリスクがありません。また、特異的なリガンドを搭載すれば、能動的ターゲッティングが可能になります。Disadvantages of LNPs include the fact that they may require cold chain logistics. In addition, sterile filtration is not always possible with LNPs and in such cases alternatives, such as gamma irradiation, heat sterilization, high-pressure sterilization or closed processing must be considered.LNPの短所は、コールドチェーン輸送を必要とする場合があることなどです。また、LNPで常に滅菌ろ過が可能であるとは限りません。そのような場合には、ガンマ線照射、加熱滅菌、高圧滅菌、閉鎖系での操作といった代替手段を検討しなければなりません。mRNA製剤とそれに関連する重要なパラメータおよび考慮事項の詳細については、ウェビナー「Key to Successful Formulation Development for Lipid Based RNA Delivery」をご覧ください。
スケールアップする際の考慮事項
mRNA製造工程をスケールアップする際には、留意すべきいくつかの考慮事項があります。これらは、小規模スケールでのプロセス開発段階において最優先すべき事項です。
- 溶媒抽出法および沈殿法によるmRNA精製は、スケールアップが難しく 、有害な溶媒の使用はGMP環境に適していません。代わりに、TFFまたはクロマトグラフィーを使用できます。
- Because mRNA can be degraded by RNases within seconds, every raw material, solution and equipment that comes into contact with the product must be free of these enzymes.mRNAはRNaseにより数秒以内に分解されるため 、対象のmRNAと接触するすべての原材料、溶液および装置はRNaseフリーでなければなりません。
- The appropriate delivery system contributes to the efficiency of the vaccine or therapeutic and should be selected carefully.適切なデリバリーシステムは、ワクチンまたは治療薬の効率を高めるため、慎重に選択する必要があります。
- If the final product is a large mRNA complex, alternatives for the sterile filtration of the product should be evaluated.最終製品が粒径の大きいmRNA複合体である場合、滅菌ろ過に代わる手段を評価する必要があります。
- Extraordinary supply chain requirements (e.g. cold chain) are a significant cost driver. Therefore, the stability of the drug should be evaluated carefully.特別なサプライチェーン要件(コールドチェーン輸送など)は、大幅なコスト増加の要因となります。したがって、医薬品の安定性を慎重に評価する必要があります。
輝かしい未来
mRNA技術によって、かつてないスピードでCOVID-19ワクチン候補品の開発および優れた有効性が実現しています。今後、mRNA技術は、感染症の大流行に対する迅速な対応を実現することでワクチン開発分野に革命をもたらすだけでなく、アンメットメディカルニーズのある疾患への遺伝子治療法による対処にも役立つでしょう。
mRNAは、迅速かつ柔軟なワクチンプラットフォームとなる可能性があります。ワクチン開発は今や、科学的に困難な課題から一歩進み、プロセス開発に重点的に取り組む段階にあります。企業は、病原体の遺伝子配列が判明すれば、比較的迅速にmRNAワクチンを設計することができます。しかし、この治療法の可能性を最大限に引き出すためには、革新的なソリューション、専門知識および創意工夫を集約させ、生産規模でシンプルかつ堅牢なプラットフォームを確立する必要があります。開発されたmRNAコンストラクトおよびデリバリーシステムの安全性、有効性、品質および製造の実現性に関連する懸念点も、評価する必要があります。
Once these challenges are addressed, mRNA-based vaccines and therapeutics will likely take their place among the advanced modalities delivering remarkable results for patients around the world.これらの課題が解決されると、mRNAベースのワクチンおよび治療薬は、世界中の患者に目覚ましい成果をもたらす最新の医療手段の1つになるものと期待されます。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?