Shady Farah,1–3 Joshua C. Doloff,1–3 Daniel G. Anderson,1–5 Robert Langer1–5
1 David H Koch Institute for Integrative Cancer ResearchMassachusetts Institute of Technology, Cambridge, MA, USA
2 Department of Chemical EngineeringMassachusetts Institute of Technology, Cambridge, MA, USA
3 Department of Anesthesiology, Boston Children’s Hospital, Boston, MA, USA
4 Institute for Medical Engineering and ScienceMassachusetts Institute of Technology, Cambridge, MA, USA
5 Harvard-MIT Division of Health Science and TechnologyMassachusetts Institute of Technology, Cambridge, MA, USA
Polymeric Drug Delivery Techniques(ドラッグデリバリーにおける高分子科学の手法), 2015, p.18
はじめに
キトサンは、多糖類の中でも高密度の反応基と幅広い分子量(Mw)を持ちます。キトサンは、N-アセチル-D-グルコサミンとD-グルコサミンがβ-(1–4)グリコシド結合により結合した直線状のヘテロポリマーで(図1)、セルロースに次いで大きく、かつ豊富に自然界に存在する多糖であるキチンの部分脱アセチル化によって得られます。アセチル化度(DA)は、キチンおよびキトサンとしての特徴を左右する重要な因子であり、全ユニット数に対するN-アセチル-D-グルコサミンの比を表しています。
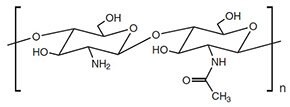
図1キトサンの化学構造
キトサンは生体組織(主に上皮および粘膜)と非共有結合を形成する能力があることから、長くにわたって有用な生体接着性材料とみなされていました。天然ポリマーを使用して形成される生体接着剤は、生体内に滞在する時間を長くして充填されている薬物をより効率よく吸収させることが可能なため、担体として適しています1。キトサンは親水性であり、アミン基のプロトン化によって酸性溶液に可溶です。様々な分子量および化学修飾の修飾および未修飾のキトサンが、生体医学2,3、医薬品4、金属キレート5,6、食品添加物7、その他の工業的用途8で広く使用されています。キトサンは生体適合性があり、リゾチーム、リパーゼ、プロテアーゼなどの酵素によって生分解することが可能です9。これらの特性や、生理学的条件で正電荷を持つことから、キトサンは生体材料として有望視されています。
ナノスフェア、ナノカプセル、ナノミセル、ナノリポソームなどのナノ粒子系薬物送達システムは、活性成分をナノ粒子の内部構造に捕捉したり、外部表面に吸着したりすることで、薬物や生体分子を送達するために使用されるナノメートルサイズの担体です1,10–11。現在、ナノ粒子(NP)は薬物、ポリペプチド、タンパク質、ワクチン、遺伝子、核酸の送達に広く使用されています。最近では、薬物送達用途で天然の多糖類を含むナノ粒子の使用に関心が高まっています12–13。多糖類とその誘導体をナノ粒子系薬物送達システムとして使用するべく多数の研究が行われており、キトサンは最も有望な候補の1つであると目されています14–16。
以下のセクションでは、キトサンナノ粒子の調製および応用の最新技術、さらにはナノ粒子およびナノミセルを含む自己集合構造の化学的修飾法を中心に紹介します。
キトサンナノ粒子の調製法
微粒子状キトサンの構造は、ポリマー鎖が架橋剤によって互いに結合した3D架橋ネットワークです。架橋したナノ粒子の性質(薬物放出や機械的強度など)を決定する主たるパラメータは、架橋密度です17。望まれるキトサンの構造特性に応じて、ナノ粒子は主に以下の4つの機構で調製されます。
- 共有結合性の架橋
- イオン性の架橋
- 高分子電解質の複合化
- 疎水的に修飾された多糖の自己集合
一般に、1~3の機構でキトサンナノ粒子を調製するにあたっては、はじめにキトサン溶液に任意の架橋剤を滴下しながら加え、1~24時間にわたって連続的に撹拌します。この際、架橋に用いる反応によって若干加熱する場合と加熱しない場合があります。一方、第4のナノ粒子調製機構は、疎水性部位の化学的性質に加えて、疎水性置換の比率(置換度:DS%)と最終的に修飾されたキトサンの濃度(ナノ粒子およびナノミセルの場合に低く、ハイドロゲルの場合には高くなる)の2つのパラメータに依存します。表1は、これらの4機構と現在の送達用途の要約および比較です。図2に、内部の相互作用を強調した架橋キトサン3D構造の実例を図示します。キトサン上の疎水基は、水中または超音波処理下で自己会合する能力18–19など、新しい物理化学的性質をもたらし、異なる種類の薬物送達システムを形成します(図2)。
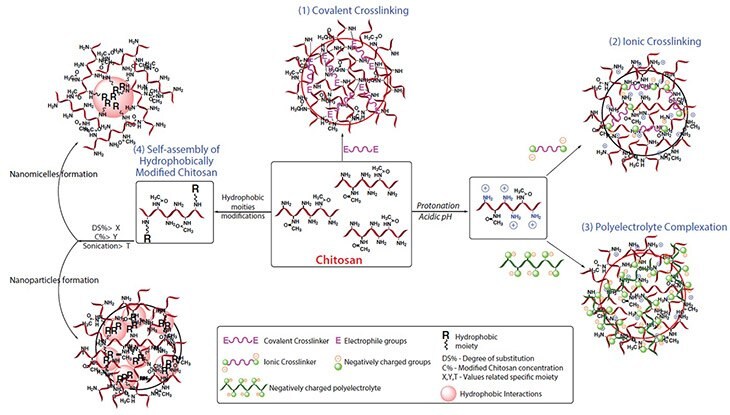
図2キトサンナノ粒子の形成機構および疎水的に修飾されたキトサンの自己集合ナノミセル
キトサンナノ粒子を作製するのにどの機構を用いるのが最適かを決めるのは容易ではありません。ナノ粒子系送達システムを合理的に設計するには、薬物の性質および担持容量、送達期間、キトサンのMw、ナノ粒子の形状およびサイズ、標的部位、生体適合性など、多くの要素を考慮する必要があります。一方、架橋剤自体の特性や化学構造などの複数の要素も架橋反応に影響を及ぼします。例えば、共有結合性の架橋では架橋剤のサイズと長さが、イオン性の架橋では架橋剤と多糖の双方の全体的な電荷が最も重要になります。さらに、共有結合で架橋されたナノ粒子とは異なり、一般にイオン性結合で架橋された粒子は薬物送達に用いるのに望ましい特性であるpH応答性を示します。
キトサンの修飾:ナノ粒子およびナノミセル
キトサンはMwが様々であることに加えて、ヒドロキシ基やアミノ基などの多様な反応基を持っており(図1)、化学修飾によって両親媒性にすることができます1。これにより新しい特性や性質の改善が得られます。疎水基のグラフトにより化学的に修飾されたキトサンには、分子内ないしは分子間での疎水性相互作用が生じます。両親媒性であるため水溶液中の自己会合が可能になり、ナノミセル、ナノ粒子、マイクロスフェア30、リポソーム31、ハイドロゲルなどの様々な薬物送達システムが得られます(図2 機構4)。このため、修飾キトサンは、様々な放出挙動を制御可能なシステムの開発において大きく注目されています。
キトサンのアミノ基はヒドロキシ基より反応性が高いため、これまでの全ての両親媒性キトサンの合成に関する研究は、N-アシル化によるアミノ基への疎水基の化学的グラフトに基づいています32。以下のセクションでは、表1(自己集合の部分)および表2に記載されているN-アシル化に基づくキトサンの化学的修飾の実験手順と現在の薬物送達システムにおける応用を概説します。
疎水性の分子およびタンパク質の送達は、投与後の生物学的利用能が低いため、常に問題になっています。ミセルを用いた担体システムは、薬物の溶解度と安定性を改善すると同時に、毒性や免疫原性の問題の克服にも役立ちます。ミセルの疎水性コアが、水に不溶な薬物を充填する容器になることはよく知られています。多糖の骨格に疎水部分をグラフトすることで、水溶液中ですみやかに自己集合してミセルが形成します。両親媒性ポリマーの凝集は、疎水基と親水性の鎖との間の相互作用のバランスで制御されます。臨界凝集濃度(CAC:critical aggregation concentration)は、ポリマーの凝集が開始する濃度です。
EDCを介したステアリン酸、リノール酸、デオキシコール酸、5β-コラン酸によるキトサンの修飾では、非常に低いCAC(0.01~0.06 mg/mL)で自己凝集が起きてナノミセルが形成することが明らかになっています33–36。両親媒性キトサン系のミセルは、ドキソルビシン37、パクリタキセル27,34,38、イブプロフェン39、両親媒性のアドリアマイシン40のカプセル化に使用されています。さらに、親水性のペプチド、タンパク質、核酸41,42もキトサン系ミセルに吸着させることが可能です。
おわりに
本稿では、キトサンとその両親媒性誘導体を用いる、化学修飾の実験法、ナノ構造調製の機構、薬物送達用途について、最近の研究を要約して概説しました。両親媒性を持つ修飾キトサンは、優れた生体適合性および生分解性、非毒性、生体接着性などの特異な性質を示すことから、ますます注目を集めています。両親媒性キトサンの自己集合は、サイズ、表面電荷、担持効率、安定性、生体内分布などの複数の特性を特定の用途に合わせて調節できるため、薬物送達システムとしてさらに有望視されています。キトサンを用いたナノミセルシステムは、疎水性の薬物およびタンパク質の送達効率と、安定性を向上させることができます。さらに、薬物放出挙動が制御可能で、生体適合性があり、特定の用途における標的化能を向上できることも示されています。これらの利点すべてが、臨床応用にむけて強い関心を集めています。
本論文の翻訳は山形大学 落合文吾教授に監修いただきました。御礼申し上げます。
掲載誌
「ドラッグデリバリーにおける高分子科学の手法 Polymeric Drug Delivery Techniques」
まとめてご覧になりたい方のためにPDFをご用意しています。
関連製品
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?