ニッケル・水素電池用金属水素化物
Dhanesh Chandra*, Wen-Ming Chien, Anjali Talekar
University of Nevada, Reno, College of Engineering Reno, NV 89557
Material Matters 2011, Vol.6 No.2
はじめに
充電式の固体電池は、コンピュータや携帯型電子機器、車載用など、広範囲にわたって使用され、ますます重要になっています。燃費が飛躍的に向上したハイブリッド自動車(HEV:hybrid electric vehicle)の開発を促進するため、1996年には、PNGV計画(The Partnership for a New Generation of Vehicles、米国政府と自動車業界との共同研究)が始められました。図1に示すように、メタルハイドライド(金属水素化物を用いた電池)とリチウムイオン電池は高いエネルギー密度を有しており、最も将来性の高い最新二次電池です1。リチウムイオン電池は最新携帯型電子機器になくてはならないものであり、ニッケル・水素(NiMH:nickel metal hydride)電池は最新のハイブリッド自動車を構成する重要な部品のひとつです。1996年の価格に基づくと、これらの材料の生産コストは、1ドル/gH未満でした(表2)2-4。NiMH電池とリチウムイオン電池は幅広い応用上いずれも重要な技術ですが、cradle-to-gate(ctg)エネルギーEctg/kgを基準にした場合、その値は他の電池よりいくぶん高くなっています(図2)5。本稿では、特に二次電池に関しての希土類金属間化合物とそれらの構造、特性、技術、応用例について紹介します。
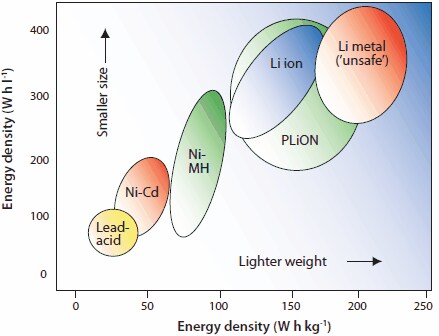
図1NiMH、鉛(PbA)、ニッケルカドミウム(Ni-Cd)、ナトリウム硫黄(Na/S)およびリチウムイオン各電池の、体積および重量当たりのエネルギー密度間の比較1
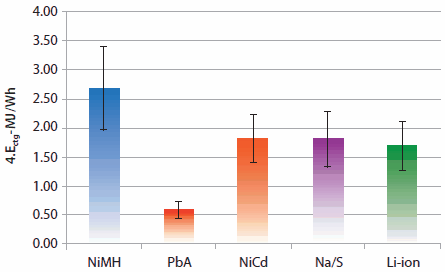
図2NiMH、鉛(PbA)、Ni-Cd、ナトリウム硫黄(Na/S)およびリチウムイオン各電池の、ワット時当たりのcradle-to-gateエネルギー(Ectg)の平均値と標準偏差5
金属水素化物は長年にわたり広く研究されてきましたが、大きな関心を集めたのは1960年代です。1960年以前の研究活動の大多数については、Mueller、BlackledgeおよびLibowitzによる書籍「Metal Hydrides」で述べられています6。最近の研究については、Schlapbach7、Sandrock8、Yvon9、Fukai10、Walker11らによる、いくつかの優れたレビューで網羅されています。一般には、その準安定な性質のために、応用する上では水素を可逆的に吸蔵/放出する準安定な二元合金もしくはより高次の合金が有望視されています。(すなわち、純粋な元素は比較的安定な水素化物を生成する傾向があるためです)。水素化物に用いられる出発合金は、構成元素をA-Bで表すと6つのカテゴリーに大別されます。単純二成分系(未置換)の例は以下の通りです。
- AB(HfNi、FeTi)
- AB2(Mn2Zn、TiFe2)
- A2B(Hf2Fe、Mg2Ni)
- A2B7(Pr2Ni7、Ce2Co7)
- AB3(NdCo3、GdFe3)
- AB5(LaNi5、CeNi5)
AB5型、LaNi5H6.7水素化物は、高い体積貯蔵密度(約130 kgH2/m3)と低い重量貯蔵密度(約2 wt.% H2)をもち、室温付近で動作します。これら水素化物の材料開発を理解しやすくするために、まず、未置換のA-B水素化物についてその水素貯蔵容量の観点から述べ、続いてA-B系で構成元素の1つを置換した場合の効果に焦点を当てて説明します。最後に、一部は既に実用化されている、より実用的な水素化物について言及します。
NiMH電池材料の熱力学と結晶構造
熱力学
固体状態で水素を貯蔵するために最初に用いられたのが、金属水素化物でした。NiMH電池用の金属水素化物として使われる合金は、主にAB5型とAB2型です。他の構造の合金についても研究されているとは思いますがここでは触れません。表1には、モデルとなる構造タイプについての重要な特性を示しました。
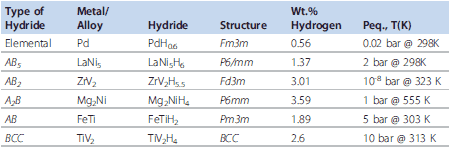
表1金属間化合物とその水素貯蔵特性12
電池への応用で最も重要な特性は、水素貯蔵容量、圧力等温線、ヒステリシス、体積の膨張/収縮、エンタルピーおよび水素吸蔵/放出温度です。実用化には、これらに加えて他の特性も重要となります。例えば、合金の活性化特性、微粉化、動力学特性、熱伝達、H2中の不純ガス、サイクル性能、安全性、大量生産時の合金の冶金加工性、コスト、およびリサイクル性などが挙げられます。
熱力学的性質は、Sieverts型装置(現在では市販されています)を用いて体積等温線を測定することにより求められます。通常は、一定温度における等温線を測定することでH/M比とHの重量%を求めます。合金が水素を吸蔵し始めると、α相と呼ばれる固溶体領域が観察されます。より多くの水素が吸蔵されるにつれてα相からβ相への相転移が起こり、プラトー領域に水素化物相が生じます。この概略図を図3に示します。x軸は水素/金属比を、y軸は圧力をそれぞれ表しています。次に、異なる温度で多くの等温線を測定することで、プラトー領域の中間組成での圧力が得られます。通常、放出と吸蔵の等温線にはヒステリシスが観察されます。1/T(K)に対してln Pをプロットすることでvan’t Hoffプロットを作成し、van’t Hoff直線の傾きからΔH/R が得られ、生成エンタルピーは(-ΔH/R)で表されます。期待される水素化物の特性は、操作窓として、f(p, T)の関数(図3B中の破線の曲線)によって予測されます。一連の主要な水素化物についてのvan’t Hoffプロットを図4に示します。これらについては、別の章で論じます。AB5型材料のα→β相転移は、以下の式によって表されます。
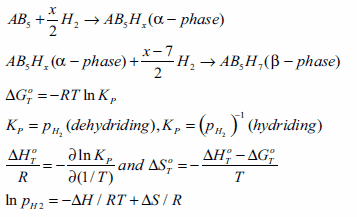
ここで、Mは金属もしくは合金(例:LaNi5)であり、初めに水素と共にα相と呼ばれる固溶体相MHyが形成されます。その後、このα相は水素化物MHxを生成します。LaNi5の場合、LaNi5-H相が最初に現れ、その後LaNi5H7が生成します。特定の温度(Tcritical)を超えると固溶体領域のみが存在するようになります。いくつかの希土類材料をはじめとする、最も代表的な金属水素化物を表1に記載しました3,4。
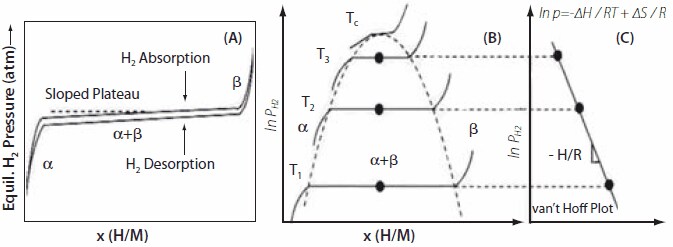
図3(A)傾きのある平坦な領域をもった水素の吸蔵と放出等温線。吸蔵と放出の等温線の間にはヒステリシスも見られます。(B)等温線のプラトー圧とα → α + β → βの相転移領域に及ぼす温度の効果。(C)さまざまな温度で得られた等温線を基に作成したvan’t Hoffプロット。傾きから水素吸蔵エンタルピーが得られます18。
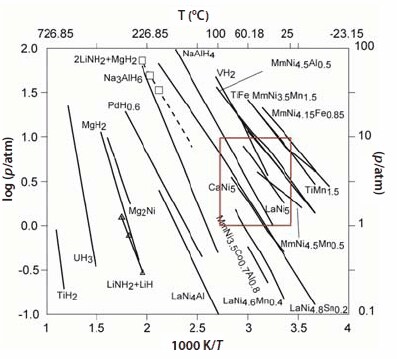
図4代表的な水素化物(標準的なものから複合水素化物まで)のvan’t Hoffプロット。四角で囲んだ領域は、自動車用途での動作に望まれる温度と圧力の領域を表します2,12,13,14,18。
後述するように、熱力学的性質が改善された多くの置換化合物が存在します。サイクル効果の単純な例として、我々が行った置換LaNi5についての研究では、10,000サイクル(それぞれ約1時間)の後に顕著な不均化が起こり、水素吸蔵特性が低下することが示唆されています(図5)。少量のSnでNiサイトを単に置換することによりサイクル寿命は著しく改善し、10,000サイクルの後でさえ、LaNi4.8Sn0.2には水素容量の有意な低下がみられませんでした(図6)。置換LaNi5合金の熱サイクルと劣化に関する詳細は、Lambertら15、Chandraら16、Percheron-Gueganら17の文献に記載されています。水素化物の長期サイクル特性と熱劣化挙動についての知見は、一定期間にわたる水素貯蔵性能を評価するために不可欠です。このように、AB5またはAB2におけるAやBの元素を適切に置換することで、サイクル寿命や耐腐食性、ヒステリシスおよび電気化学的特性を向上させることができます。次章では、最適な化学量論組成をもつ電池用合金について論じます。
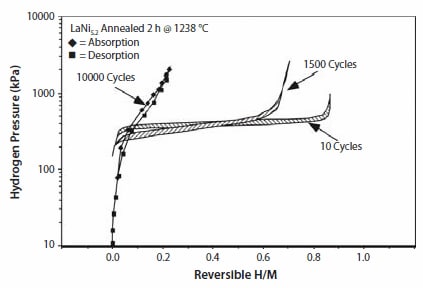
図525℃で測定したLaNi5.2の等温線。10回、1,500回、および10,000回の所定のP-T サイクル(活性化)の後、水素化物の著しい劣化が見られます15。
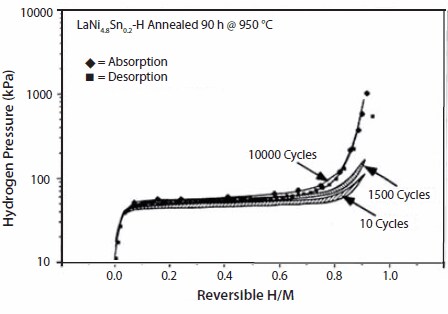
図625℃で測定したLaNi0.8Sn0.2の等温線。LaNi0.8Sn0.2の場合、1,500回、および10,000回の所定のP-T サイクルの前後で、水素容量がほとんど低下していないことがわかります15。
電池材料の結晶構造
MH(メタルハイドライド)電池に重要な特性は、耐久性/サイクル寿命、水素容量、および充電/放電効率です。この点では、AB5とAB2の希土類金属水素化物は、プラグインハイブリッド電気自動車(PHEV:plug-in-hybrid-electric vehicle)や電気自動車(EV:electric vehicle)で長期にわたって使用するのに最も適したものです。これらはNiMH電池と呼ばれており、外気温度付近で動作します。例えば、トヨタ プリウス(II~Vモデル)では密閉型NiMH電池が使用されていますが、その電池寿命はメーカー研究所のベンチテストでは150,000マイルと推定されています19。NiMH電池のサイクル寿命とエネルギー密度がさらに向上すれば、やがて公開される電気自動車には、これらの信頼性の高い、高エネルギー密度電池が搭載されるかもしれません。この種の水素化物は現在「古いタイプの水素化物」と呼ばれていますが、AおよびB成分のマイクロアロイングによって、電池の電気化学的性質およびサイクル寿命が向上するなど、優れた電池特性が達成されています。
AB5およびAB2水素化物材料の結晶構造
AB5およびAB2化合物の結晶構造の一覧を表2に示します。AB5化合物は原子比が厳密な金属間化合物です。AB2は金属間化合物もしくは(均一な組成の領域が少ない)中間化合物で、1:2の化学量論組成を厳密にもたない可能性があります。
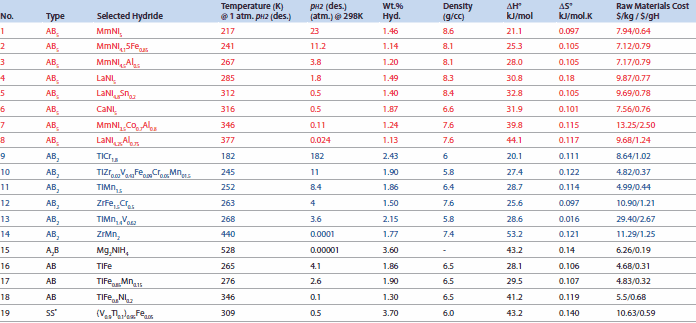
表2代表的な水素化物と、それらの水素容量およびプラトー圧(価格基準:1996年中頃)3,4,8
AB5化合物の構造
多くのNiMH電池には、AB5型構造をもつ材料が用いられています。主要な合金材料は、基本的にLaNi5とMmNi5(ミッシュメタル-ニッケル合金)で、特性を改善するためにAとBの元素は必ず置換されます。LaNi5は、Strukturbericht分類D2dの六方晶系の結晶構造(CaCu5型、P6/mmm、a = 5.0228 Å、c = 3.9826 Å)をとります。LaNi5の構造には、Laのサイトが1つ(1aサイト)と2つの異なるNiサイトがあります。一つのNiサイト(2cサイト)はLa原子によって囲まれており、他方のNiサイト(3gサイト)はNi原子のみで構成される六方晶系構造の中間の層に位置します。多くの場合、過剰なNi(例えば、LaNi5.2)が存在し、これによってc/a比が変化します20。LaNi5金属間化合物とその水素化物の構造を図7に示します20-22。
.gif)
図7LaNi5 20,21とLaNi5H7 22の結晶構造
LaNi5の水素化物はLaNi5H7で、通常は秩序化した結晶構造をもっており、原子比が厳密な化合物です。Latriugeは、その構造がP63mc、a = 5.409 Å、c = 8.6 Åである六方晶系の二重格子であると報告しました21, 22。また、Joubertら23やThompson、Reilly、Hasting24、および他の多くのグループも、この構造を報告しています。
実際に用いられている電池材料は、AB5構造をベースとした化合物です。市販されている合金の1つでは、LaNi5のAサイトが、原子番号51~71の多数の元素の混合物であるミッシュメタル(Mm)で置換されています。Bサイトは、Co-Al-Mnで置換されます。これらの置換化合物にはさまざまな種類があり、電池メーカーが特許権を保有していますが、いくつかの有望な合金を表2(No.1~8)に示しました。合金MmNi3.5Co0.7Al0.8(図4と表2)は電池に適した特性をもっていると考えられますが、可逆的容量で正規化した原料コストは最も高くなっています。コストやその他の理由を考慮すれば、Coは理想的とはいえませんが、耐腐食性があるために少量を混ぜて合金化されています。
AB2化合物の構造
AB2型の材料は、通常、ラーベス相構造(Strukturbericht分類C14とC15)をとります。これは、異なるタイプのNiMH電池であり、主要な材料を表2(No.8~14)に示しました。これらの材料もまた、AB5水素化物と同様に外気温度付近で充電/放電します。C14材料は、立方体、斜方晶、六方晶のいずれかの構造をとることが一般的です。図8に、C14相とC15相の2種類の一般的な構造を示しました。C14の代表的な例はZrMn2であり、単位格子中の分子組成単位の数であるZ値が4の六方晶系構造(ZrMn2)を持ち、ガス分離用途に使われています。ZrV2型材料で見られるようなAB2のC15構造はZ = 8であり、YvonはH原子がA2B2の四面体間隙を占有すると報告しています27。AB2化合物の例としては、GdMn2やHfV2、CeNi2、TiCr1.8などが挙げられます。
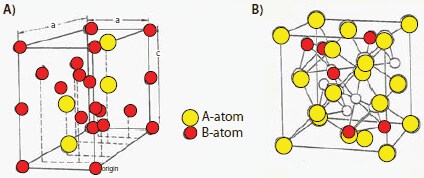
図8(A)C14ラーベス相25および(B)C15ラーベス相26の代表的な構造
このAB2の場合、一般的なA元素は、Ti、Zr、Hf、およびその他の希土類元素(Luを除く)です。一般的なBサイトの元素は、Cr、V、Fe、およびMnです。電池性能を改善するために、AとBを置換した多くの化合物の合成が可能です。ダイムラーベンツ社は、低価格の商業用合金であるTiZr0.02V0.43Fe0.09Cr0.05Mn01.5(表2のNo.10)を開発しています28。
NiMH電池用に応用できる可能性の高い第3番目の種類の材料に、AB水素化物があります。これらは、通常、「CsCl」型構造(Strukturbericht分類B2、空間群Pm-3m)をとります。Libowitz29が最初に報告したのは、約100℃で水素化したZrNi水素化物でしたが、1974年にReilly30は、FeTiHとFeTiH1.5を形成し、30℃で2つのプラトーを示すFeTi合金(表2、No.17)を開発しました。Reilly31はまた、40℃でH/M = 1を示すTiFe0.7Mn0.2も見出しています。さらに、Sandrock32はTiFe1-yAly(y = 0.04~0.10)、TiFe0.85Mn0.15、およびTiFe0.8Ni0.2(表2、No.17と18)を報告しました32。
AB5とAB2化合物におけるAとBの置換
原子比が厳密な水素化物には、LaNi5、YNi5、CeNi5、MmNi5などがあります。優れた特性を得るために、AとBの元素は通常置換されます。例えば、所望のプラトー圧を得るために、等温特性を場合によっては動作温度付近でほぼ2桁変化させます。LaNi5は1.5 atmのプラトー圧をもつモデル化合物であり、NdNi5やCeNi5なども高いプラトー圧を示します。Aサイトの置換には、市販のミッシュメタル合金混合物(La、Pr、Ce、Nd)が使われます。この場合、ヒステリシスは増加しますが水素貯蔵容量は減少しません。部分的な置換も可能で、Mm1-xCaNi5などの化合物ではプラトー圧ならびにヒステリシスが減少します。PtやCuなどでBサイトのNiを置換しても、目立った成果は得られません。一方、Bサイトの部分的な置換によって熱力学的性質は大きく変化します。電池用途では、水素吸蔵/放出間の体積変化が最小限であることが重要ですが、Coの添加によって体積変化が減少することが明らかになっています。Sakaiは、電池電極用に用いられている、完全に置換されたMmNi5に若干Coが含まれていることで電極寿命が改善されていることを報告しています37。また、簡略のため本レビューには記載しなかった特許や文献もあります。Co、Al、およびMnを含有する市販のB置換MmNi5合金は、1 bar未満のプラトー圧と優れた耐腐食性を示します。市販の電極合金の組成はおよそMmNi3.5Co0.8Mn0.4Al0.3であることが示唆されています。この合金は、電池用途のほかに、燃料電池や他の据え置き型水素貯蔵用途に対しても商業的価値の高い材料です。Sn、Mn、In、およびSiによる部分的なBサイトの置換によっても、優れた性能を発揮する水素化物が得られています。最適な水素吸蔵特性の得られる最も興味深い元素は、AlとSnです。よく知られたLaNi4.5Al0.5はトリチウム関連の応用に使われてきました。単一のB元素置換の例は、LaNi5.2とLaNi4.8Sn0.2で示しました(図5および図6)。合金元素を変えることで、熱サイクル寿命が大いに影響を受けることがわかります。Bowmanはこれら合金の特性を改善し、宇宙で使用されるヒートポンプに使われています33。その上、このような置換によって、サイクル寿命が改善できることも明らかになっています34。また、AB2化合物においても希土類元素が置換されます。MmMnAl、LaMnAl、TiZr0.02V0.43Fe0.09Cr0.05Mn01.5、およびTiMn1.4V0.62などの化合物は、応用上いずれも重要な材料です。また、SandrockとGoodellは、Fe0.85Mn0.15Ti0.5の大気圧サイクル試験を行い、ガス不純物がサイクル性能に与える影響を明らかにしました35。
NiMH電池の電気化学的反応
NiMH電池の概略図を図9に示します。負極は金属水素化物、正極はNiO(OH)/Ni(OH)2、電解液はKOHです。正極側では、Ni(OH)2電極が充電の間にNiO(OH)に酸化され、放電の間にNi(OH)2へ還元されます。負極では、金属水素化物が放電の間に還元されて合金になります。充電-放電酸化還元反応式を図9にも示しました。重要なのは、このタイプの電池ではNi/Cdやその他の電池で見られるような析出メカニズムが存在しない点です。充電/放電メカニズムは、Ni水酸化物と金属水素化物の間でのプロトン移動を通して進行するためです。
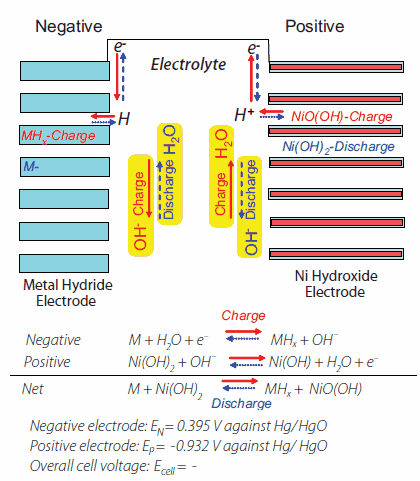
図9NiMH電池の充放電メカニズム36
![table-3 LaNi5 系合金中のLaを他の希土類元素で置換した効果。(注)C(0): The capacity extrapolated to the 0th cycle, C(100): Capacity after 100 cycles. Mm(1): Synthetic mishmetal [La:26%, Ce:52%, Nd:16%, Pr:6% (in atom%).] Mm(2): Bastnasite (natural mishmetal) [La:18-28%, Ce:50-55%, Nd:12-18%, Pr:4-6%, and others: <2% (in atom%)].](/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/materials-science-and-engineering/batteries-supercapacitors-and-fuel-cells/table-3.gif)
表3LaNi5系合金中のLaを他の希土類元素で置換した効果37
一般的に、電池にはMm(Ni,Co,Mn,Al)5粉末またはそれに非常に近い組成の化合物が用いられています。1999年のレポートによれば、28 kwhのエネルギー容量の電池で、三菱リベロEVの走行距離は220マイルに達しています3。NiMH電池のサイクル寿命は通常1,000回を超えますが、計算上のエネルギー密度がAB5で220 Wh/kg、AB2で230 Wh/kgの範囲にあるのに対し、(実際の)比エネルギー密度は70~80 Wh/kgです37。MmNi3.6Al0.4Co0.7Mn0.3合金の放電容量は、長期間のサイクルの後、容量がわずかに(約20 mAh/gの程度)低下しますが、250 mAh/gにとどまります。複合置換合金であるMmNi5[(La0.58Ce0.29Nd0.08Pr0.05) (Ni3.6Co0.7Mn0.3Al0.4)]についての研究も行われており(スウェーデン)、焼結した水素化物電極を用いることによって活性化が改善され、高い放電容量が得られています38。他の例として、Mm0.95Ti0.05Co0.45Mn0.35Al0.15と比較したLaNi4.7Al0.3のサイクル寿命を図10に示します39。さらに、LaNi4.8Sn0.1+xの電気化学的サイクル試験では、LaNi4.8Sn0.1やLaNi4.8Sn0.4などの化学量論組成から外れた合金よりも、LaNi4.8Sn0.2の方が周期的安定性に優れていることが明らかになっています(図11)。

図10Mm0.95Ti0.05Co0.45Mn0.35Al0.35とLaNi4.7Al0.3の放電容量39
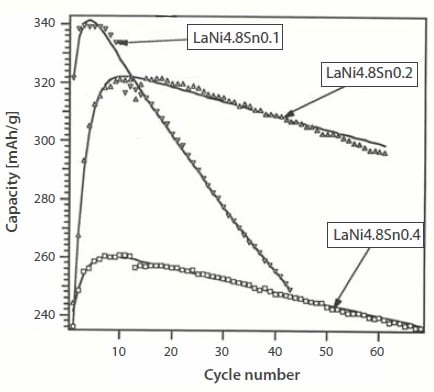
図11非化学量論組成合金LaNi4.8Sn0.1+xの放電容量40
NiMH電池利用の社会的影響
ニッケル・水素(NiMH)電池は、ハイブリッド自動車用バッテリー、電気カミソリ、歯ブラシ、カメラ、ビデオカメラ、携帯電話、ポケットベル、医療機器/装置、およびその他多数の用途で利用されています。リチウムイオン電池技術は加速度的に発達しており、技術競争力を保つために、NiMH電池材料の開発も継続して行わなければなりません。とはいえ、MJ/Wh基準では、NiMH電池はリチウムイオン電池よりもわずかに優れたサイクル寿命を有しているようです(図2)。2010年型トヨタ プリウスには三洋電機製NiMH電池が使用されている点にご注目ください。
金属水素化物は、電池技術の他にもいくつかの用途があります。例えば、車載用燃料電池や内燃機関(IC:internal combustion)エンジン用の水素貯蔵があります。水素自動車はCO2の代わりに水を排出するので、これらは環境的にもつ意味も大きい技術です。多くの企業が水素/燃料電池で動く自動車の試作モデルを製作しており、コロラド州のHCI社(Hydrogen Components, Inc.)のFrank Lynchは、これらの水素化物を用いてキャタピラー社トラクターを動作させるための金属タンクを1970年代に開発しています。実用的な最新自動車のための主要な課題は、可逆的かつ約10 wt.%の水素貯蔵容量をもつ、信頼性の高い軽量の水素化物の開発です。さらなる開発と最適化により、いつの日か、表2に示した合金の中から実用化される材料が見出されることが期待されます。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?