エネルギー貯蔵用イオン液体
John D. Stenger-Smith<sup>1</sup>, Jennifer A. Irvin<sup>2</sup>
Material Matters 2009, Vol.4 No.4
はじめに
イオン液体(室温イオン液体、常温溶融塩)は、室温または室温付近で液体の有機塩類です。この塩(図1)は、揮発性が非常に低いこととさまざまな化合物に対する溶解性の高さによって、大きな関心の的になってきました。これら性質の組み合わせによって、イオン液体はエネルギー用途や産業プロセス向けの「グリーン」溶媒として有用です。

図1イオン液体を構成する一般的なカチオンとアニオン
一部のイオン液体については、もう1つの有用な特性として、6.0 Vにも達する広い電気化学的に安定な(電位)窓を持つことが挙げられます1。この広い電位窓のために、イオン液体は電気化学用の電解質として有望な材料です。広い電位窓は優れた性質である反面、電解質として使用できないほど粘性が高く、導電率が不十分な場合もあります。粘性が高いことでしばしば酸化電位が高くなることが多くなり(質量輸送速度が低いため)、反応時間が長くなることがあります2。表1に示したいくつかのイオン液体電解質(ILE: ionic liquid electrolyte)の各性質の結果からも、そのトレードオフの関係にあることが明らかです。
ILEの出現によって大きな恩恵を受けてきたのは、電場応答性高分子(電気活性ポリマー)の分野です。電場応答性高分子(EAP:electroactive polymer)は、一般に2つもしくはそれ以上の安定な酸化状態を行き来することができるため、導電率、色、体積などの特性変化を引き起こします。色の変化はディスプレイや自動調光窓などのエレクトロクロミック用途につながる一方、体積変化は人工筋肉や微小電気機械素子(MEMS)などの電気機械アクチュエータ用途につながります。EAPを組み込んだ装置は、過去30年間にわたり集中的に研究されてきました。このポリマーは、中性形、p型ドープされた酸化形、およびn型ドープされた還元形の間を行き来することができるため、さまざまな電極構成をとることが可能です。電場応答性高分子の利用例には、電気化学キャパシタ3、充電式バッテリー4、およびエレクトロクロミックデバイス5での使用があります。図2に、EAPの一般的な酸化還元反応を示します。
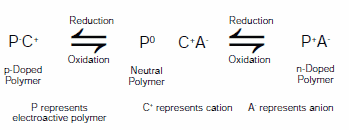
図2電解質(C+A-)の存在下でのn型ドープ、中性型、およびp型ドープ状態の間で切り換わる電場応答性高分子(P)の反応スキーム
図2に示すように、EAPの酸化、中和、および還元には、電荷保存則に従うためにイオンの移動が必要です。イオンの種類によって、モルフォロジーや安定性、酸化還元電位が変化します6。イオンは、水やアセトニトリル、または炭酸プロピレンに溶解したテトラアルキルアンモニウム塩などの電解質溶液を用いて導入されます。図1に示したイオン液体は、EAPを用いた系の代替電解質として大きな関心を集めており、そのまま使用したり、他の溶媒と組み合わせて使用することができます7-9。ILEの利点には、広い温度範囲で使用できる電位窓、難揮発性、優れた電気化学的および熱的安定性などがあります10。他の溶媒を加えずにイオン液体のみを電解質として用いた場合、EAPデバイスの切り換え安定性が溶液を電解質として用いた場合と比較して大幅に改善されます11。
スーパーキャパシタおよび電池へのイオン液体の応用
電気化学キャパシタ(スーパーキャパシタ)
電気化学キャパシタ(EC:electrochemical capacitor)はスーパーキャパシタとも呼ばれ、電場応答性高分子、金属酸化物、または炭素質材料の酸化と還元を利用して電気エネルギーを貯蔵する、電力平準化用の電荷蓄積デバイスです。充電プロセスではECの電極が還元(陰極)および酸化(陽極)されて電気エネルギーを貯蔵し、次に放電中にこの電気エネルギーを放出して電極材料が中性状態に戻ります。図3に、エネルギー貯蔵量を最大化するためにp型ドープ(陽極)とn型ドープ(陰極)のポリマーを組み合わせた構造をもつECの動作についての模式図を示します。

図3電場応答性高分子を使用した電気化学キャパシタの充電中(左)および放電中(右)の電子の流れとイオンの移動を表した模式図。充電中、陰極(n型ドープ)側のポリマーは負に帯電し、カチオンが電解質から移動して電荷を補償します。同時に、陽極(p型ドープ)側のポリマーは正に帯電し、アニオンが電解質から移動して電荷を補償します。放電中は両方のポリマーがそれぞれ中性状態に戻り、イオンは溶液に戻ります。
ECの最も重要な用途には、携帯型電子機器のメモリー保護システム、電力負荷平準化、電気自動車でのエネルギー貯蔵などがあります。ECは、一般に電池より単位質量あたりの出力電力が大きく、従来のキャパシタより単位質量あたりで多くのエネルギーを貯蔵します。したがって、電気自動車に必要な短時間の大電力供給に利用できるかもしれません。また、どのECも動作するには電解質が必要ですが、イオン液体を使用7,12すると揮発性で有害な従来の溶媒が不要になり、これらのデバイスの動作安定性を改善することができます。
リチウムイオン電池
Liイオン電池は民生用電子機器市場に広く普及しており、最終的に大規模な商業用大電力エネルギー貯蔵を独占する可能性があります。Liイオン電池は、リチウムがインターカレートした酸化物と炭素の2つの電極が電解質をはさんだ形をとります(図4)。電池を充電すると、リチウムイオンが酸化物電極から炭素電極に移動してエネルギーが貯蔵されます。電池を放電すると、リチウムイオンが酸化物電極に戻ってエネルギーが放出されます。リチウムイオンの輸送は電解質によって促進されますが、通常、電解質には揮発性の可燃性溶媒が含まれています。したがって、従来の電解質を含むLiイオン電池では安全性が大きな問題になります。可燃性溶媒の存在下で短絡や局所的な過熱が生じた場合、熱暴走、火災、さらには爆発が起こるおそれがあるためです。可燃性溶媒をイオン液体で置き換えることで電池の安全性が向上するため、リチウムイオン電池に対して特に有効であると考えられます10。

図4リチウムイオン電池における放電中(左)および充電中(右)の電子の流れとリチウムイオンの移動
さらに、電気化学キャパシタの電解質とは異なり、Liイオン電池の電解質はリチウムイオンの輸送を促進し、非常に高い負電位で安定性を維持し、電池の安定動作をサポートしなければなりません。この要件を満たすことができる材料として、イオン液体の研究がいくつかのグループによって行われています10,13。これまで研究されたイオン液体には、N-butyl-N-ethylpyrrolidinium bis(trifluoromethylsulfonylimide)、ethylmethylimidazolium bis(trifluoromethylsulfonylimide)、N-methyl-N-propyl pyrrolidinium bis(trifluoromethylsulfonylimide)、N-methyl-N-propyl piperidinium bis(trifluoromethylsulfonylimide)などがあります。これらのうちどれか1つを使用して、リチウムイオンが活性物質であるlithium bis(trifluoromethane sulfonylimide)溶液を調製することができます。
極端な温度でのイオン液体
エネルギーの生成と貯蔵への注目が高まるとともに、幅広い温度で動作する電荷蓄積デバイスの需要が増加しつつあります。自動車産業では、電荷蓄積デバイスが-30℃の低温でも使用可能であることが理想的です14。軍事用途での要求はさらに厳しく、場合によっては-60℃という低温が目標になります15。低温、特に-60℃にもなるとほとんどの電池で性能低下が極めて顕著になります16。充電/放電プロセスでの速度低下とは別に、低温では電解質の粘度が増加して電解質の電荷輸送性能が低下します。このような特性変化により、低温に長時間さらされると素子の性能低下や故障が発生します。溶液系電解質に対する低温の最も大きな影響の1つは電解質物質の溶解度低下で、その結果、塩が析出したり電気化学キャパシタや電池の破壊につながることがあります。表1に示されるように、自動車産業が要求する中程度の低温では多くのイオン液体電解質が使用できますが、軍事用途に要求される極端な低温で機能するものはほとんどありません17。さらなる課題は、これらの電解質が、同様の広い温度範囲にわたって各種モノマー/ポリマーを用いた系での電気化学プロセス(堆積、酸化、還元、素子の動作15、その他)をサポートしなければならないことです。残念ながら、極低温で液体状態を保つILEはごく少数であり、ほとんどの電気化学用途に使用できないほど粘度が高くなる可能性があります。そこで、異なるイオン液体を混合したり粘性低減のための添加剤を使用したりすることで、この影響を緩和することができます。一方、エネルギー貯蔵産業では60℃までの高温での電気化学デバイスの性能も関心の一つです14。残念ながら、ほとんどの溶媒系電解質は高温における溶媒の高い揮発性が問題になります。密封された系内では蒸発した溶媒が火災や爆発を引き起こすおそれがある一方で、開放系では、電解質の沈殿、電荷蓄積材料の分解、および電荷蓄積機能の喪失が生じることがあります。したがって、揮発性が極めて低いイオン液体は、高温で使用する際の最適な電解質といえます。
その他の用途
イオン液体の潜在的に有望な用途は、この他にも多数あります。例えば、広い電気化学的窓と低い蒸気圧のために、金属や半導体の電気めっきに適しています18。イオン液体は、高温型燃料電池を可能にする技術としても有望です19。水を溶媒として選択できない100℃を超える温度において、イオン液体は多くの場合、従来の水溶液によるプロトン輸送系の優れた代替手段になります。電場応答性高分子またはイオン交換ポリマーを使用した電気機械アクチュエータは、動作を円滑にするために電解質を必要とします。イオン液体を用いることによって、これらデバイスの長期安定性が向上することが明らかになっています20。その最も顕著な例は、おそらくエレクトロクロミックデバイスであり、ポリアニリン系エレクトロクロミックディスプレイに電解質として1-butyl-3-methylimidazolium tetrafluoroborateを使用すると、100万サイクル後でも電気活性の大幅な低下は観測されませんでした10。
純度要件
エネルギー貯蔵用途に使用される電解質の純度は、電気化学デバイスの安定性と性能にとって極めて重要です。イオン液体も例外ではありません。イオン液体の調製に用いられる合成経路によっては、材料中に水、過剰なカチオンまたはアニオン、あるいはその他の溶媒が不純物として含まれることがあります。微量の混入物質でも、好ましくない副反応が生じてEAPデバイスの性能を損なう場合があります。例えば、塩化物や水の不純物がイオン液体の粘度に影響を及ぼすことが明らかになっています21,22。また、少量(数ppm)のアルミナ、シリカなどの吸着剤によっても、電気化学的性能が低下すると報告されています23。電気化学用途に適したイオン液体を調製するための精製方法として、多くの場合、カラムクロマトグラフィーや真空蒸留(揮発性不純物を除去するため。イオン液体自体は蒸留されません。)が用いられます。多くの一般的な物質についての精製方法が報告されており、注意深く行う必要があります21-23。
まとめと結論
多くのイオン液体は、非常に低い揮発性と電気化学的安定性を備えているため、エネルギー貯蔵装置の電解質材料として優れた選択肢になります。また、電気化学用途には厳密な精製が求められます。イオン液体電解質を使用したデバイスでは、優れた電気化学的安定性が観察されます。イオン液体電解質は極端な温度でも使用可能である特徴を持ち、電気自動車やその他多くの用途における有望な候補物質となっています。
謝辞
J. Stenger-Smithは、米国海軍省科学技術本部(the Office of Naval Research、特に、M. Anderson、P. Armistead、R. Carlinの各博士)およびthe Power Sources Strategic Technology Initiative officeの支援に感謝します。J. Irvinは、米国海軍省科学技術本部、アメリカ化学会(ACS)Petroleum Research Fund、およびウェルチ財団(the Welch Foundation)の支援に感謝します。また、有益な助言をいただいたAndrew P. Chafin氏、David J. Irvin博士、Andrew Guenthner博士、およびMariem Rosario-Canales博士に、我々二人より感謝します。
本稿に掲載した見通しは著者のものであり、必ずしもDoD(米国国防総省)またはその各組織の見解を表すものではありません。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?