DNAオリゴヌクレオチド合成
1980年代に開発され、固相担体と自動化によって強化されたホスホロアミダイト法は、DNAオリゴヌクレオチドの製造に最適な方法です。生合成とは逆に、化学合成は図1に概説したステップに従って3'→5'の方向に進みます。注記:このページではDNA合成のみを取り上げます(RNAの化学合成も類似していますが、異なる点があります)。
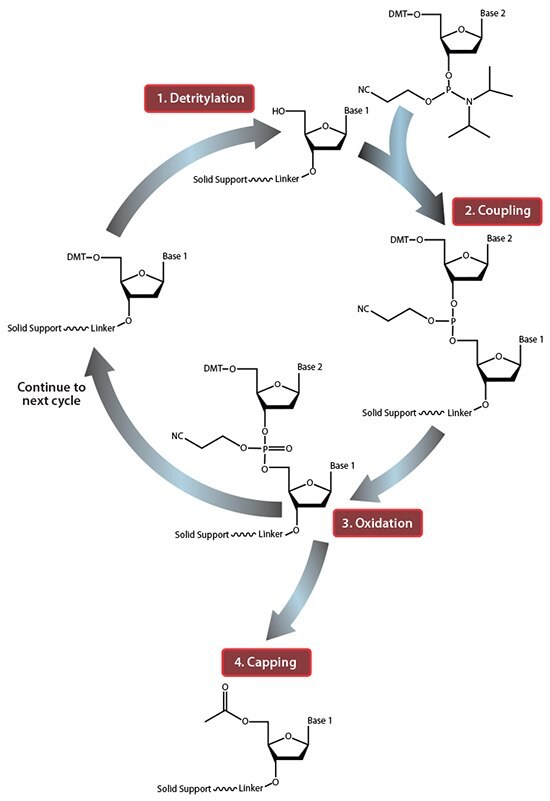
図1.固相オリゴヌクレオチド合成サイクルの概要ステップ1:脱トリチル化では、最初の固体担体結合ヌクレオシドから5'-DMT保護基を除去します。ステップ2:カップリングでは、最初の固体担体結合ヌクレオシドの活性のある5′-OHが、続いて結合するヌクレオシドのリンに結合し、ジイソプロピルアミノ基と置換します。ステップ3:酸化では、不安定な亜リン酸トリエステルを安定なリン酸トリエステルに変換し、次のサイクルを第2のヌクレオシドのステップ1:脱トリチル化に進めます。ただし、次のサイクルに進む前に、ステップ4:キャッピングにおいて、未反応の5′-OHを有する固体担体結合ヌクレオシドをアセチル化し、次のカップリング反応を防止します(酸化の後にキャッピングを行い、反応の次のサイクルを妨げるおそれがあるすべての水を除去します)。
オリゴヌクレオチド合成 ホスホロアミダイト法
この項では、ホスホロアミダイト法の4ステップ[ステップ1(脱トリチル化)、ステップ2(カップリング)、ステップ3(キャッピング)、ステップ4(酸化)]それぞれの詳細な化学的説明を取り上げます。
ステップ1(脱トリチル化)
このサイクルは、固体担体に結合したヌクレオシド(オリゴヌクレオチドの3'端塩基を含みます)の5'-DMT(4,4'-ジメトキシトリチル)保護基を除去することによって始まります。5'-DMTは、固体担体樹脂の機能化時に、ヌクレオシドの重合を妨げます。メカニズムを図2に示します。

図2.脱トリチル化のメカニズムジクロロメタン溶媒中で5'-DMT保護基をTCA(トリクロロ酢酸)によって除去します(TCA溶液の濃度が高すぎる、または脱トリチル化の時間が長すぎると、脱プリンが起こり、それによって最終オリゴヌクレオチドの全体の収量が低下します)。生成物は、遊離5'-OHをもつ3'末端ヌクレオシド、DMTカルボカチオンなどです(電子非局在化によって形成される共鳴構造は示されていません)。ヌクレオシドは合成のステップ2に進む一方、DMTカルボカチオンは495nmの光を吸収して橙色を発し、この色がカップリング効率の監視に使用されます。
ステップ2(カップリング)
DMTを取り除くと、固体担体結合ヌクレオシドの遊離5'-OHが、次のヌクレオシド(ホスホロアミダイトモノマーとして添加)と反応できるようになります。メカニズムを図3に示します。
![カップリングのメカニズムアセトニトリル溶媒中で、入ってくるホスホロアミダイトモノマーのジイソプロピルアミノ基を、酸性触媒ETT[5-(エチルチオ)-1H-テトラゾール]によって「活性化」(プロトン化)します。試薬は固体担体に送達されるため、撹拌は合成装置の流体ラインで行います。活性化したホスホロアミダイトを、固体担体結合ヌクレオシドを何倍も上回る量で送達し、反応を可能な限り終了に近づけます。生成物は、亜リン酸トリエステル結合をもつジヌクレオシド、遊離ジイソプロピルアミノ基などです。 カップリングのメカニズム](/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/genomics/pcr/dna-figure-3/dna-figure-3.jpg)
図3.カップリングのメカニズムアセトニトリル溶媒中で、入ってくるホスホロアミダイトモノマーのジイソプロピルアミノ基を、酸性触媒ETT[5-(エチルチオ)-1H-テトラゾール]によって「活性化」(プロトン化)します。試薬は固体担体に送達されるため、撹拌は合成装置の流体ラインで行います。活性化したホスホロアミダイトを、固体担体結合ヌクレオシドを何倍も上回る量で送達し、反応を可能な限り終了に近づけます。生成物は、亜リン酸トリエステル結合をもつジヌクレオシド、遊離ジイソプロピルアミノ基などです。
ステップ3(酸化)
カップリング反応中に形成される亜リン酸トリエステルは非天然の不安定な化合物であるため、次のサイクルの開始前に、より安定なリン類に変換しなければなりません。酸化によって、亜リン酸トリエステルを安定なリン酸トリエステルに変換します。メカニズムを図4に示します。

図4.酸化のメカニズム。亜リン酸トリエステルの酸化は、水とピリジンの存在下でヨードによって行います。生成物はリン酸トリエステルで、これは基本的に、遊離酸素上にβ-シアノエチル保護基をもつ標準DNA構造です。
ステップ4(キャッピング)
カップリング効率100%は不可能であるため、未反応の5'-OHをもつ、固体担体結合ヌクレオシドが常にいくらか存在します。このままにしておくと、これらのヒドロキシル基が次のサイクルで反応を起こし、塩基損失を引き起こします。連続サイクルを経てこれら未反応物が蓄積すると、精製が困難な「ショートマー」の複合体混合物が生成し、オリゴヌクレオチドが目的の用途において使用できなくなるおそれがあります。ショートマーの蓄積を防止するために、キャッピングが必要です。メカニズムを図5に示します。

図5.キャッピングのメカニズム。少量のピリジンを含むテトラヒドロフラン溶媒中で、無水酢酸とN-メチルイミダゾールを反応させて中間体を形成します。試薬は固体担体に送達されるため、撹拌は合成装置の流体ラインで行います。生成物は、アセチル化した5'-OHをもつ固体担体結合ヌクレオシドです(ピリジンが塩基性pHを維持するため、遊離酢酸/酢酸によるホスホロアミダイトモノマーの脱トリチル化が阻害されます)。
連続サイクル
第2のサイクルはステップ1の脱トリチル化から始まり、残りの3ステップそれぞれが続きます。繰り返されるサイクルの数は、目的とする塩基の数と同じです。メルクでは2~120塩基のオリゴヌクレオチドを合成します。
切断
固体担体/リンカーを、合成が終了したらオリゴヌクレオチドから切断します。オリゴヌクレオチドをプライマーとするPCRでのDNAポリメラーゼによる伸長などの、生化学反応に遊離3'-OHが関与できるようにするためです。反応物と生成物を図6に示します。

図6.切断の反応物と生成物リンカーのエステル加水分解(と同時に固体担体の除去)を、濃縮アンモニア水での処理によって行います。生成物は、末端の遊離3'-OHをもつオリゴヌクレオチドです。
脱保護
切断後、オリゴヌクレオチドの濃縮アンモニア水溶液を加熱し、塩基およびリン酸から保護基を除去します。
塩基
チミンは保護基を必要としませんが、アデニン、シトシン、グアニンは環外第一級アミノ基を有するため、保護基が必要です。オリゴヌクレオチドと標的核酸の間に適切な水素結合を形成させるためには、保護基を取り除かなければなりません。反応物と生成物を図7に示します。

図7.塩基脱保護の反応物と生成物濃縮アンモニア水中のオリゴヌクレオチドを加熱します。保護基には以下が含まれます:N(6)-ベンゾイルアデニン、N(4)-ベンゾイルシトシン、N(2)-イソブチリルグアニン。反応生成物は、完全に脱保護されたアデニン、シトシンおよびグアニン塩基。
標準的な保護基に加えて、アンモニアに弱い修飾オリゴヌクレオチドには、変化しやすいなジメチルホルムアミジルグアニンやマイルドな保護基を使用することができます。当該塩基上のこれらの保護基を図8に示します。

図8.変化しやすくマイルドな保護基。ジメチルホルムアミジル保護基は、一般的に濃縮アンモニア水中で加熱によって除去しますが、イソブチリル基より大幅に短い時間で除去が可能です。マイルドな保護基には以下が含まれます:N(6)-フェノキシアセチルアデニン、N(2)-アセチルシトシン、N(2)-イソプロピルフェノキシアセチルグアニン。これらは通常、濃縮アンモニア水/メチルアミン溶液中、室温で除去します。
ホスホジエステル形成
リン酸トリエステルからリン酸ジエステル(ホスホジエステル)に変換するには、リン酸の遊離酸素上のβ-シアノエチル基を除去しなければなりません。メカニズムを図9に示します。

図9.脱保護によるホスホジエステル形成のメカニズムシアノエチル基を濃縮アンモニア水中でβ-脱離によって除去します。電子求引性のシアノ基に隣接する炭素上の水素原子は強酸性であるため、反応は速やかです。生成物は、天然のホスホジエステル骨格をもつオリゴヌクレオチドとアクリロニトリルです。
収率
合成の収率はカップリング効率に大きく依存します。効率99.5%は容易に達成できますが、それでも、表1から、オリゴヌクレオチドの長さの増加とともに、収率が急激に低下することがわかります。
カップリング効率が収率を決定するすべてではないことを、頭に入れておく必要があります。脱保護、切断、精製(単純な脱塩であっても)によって、収率はさらに低下します。生産規模と精製による弊社保証収率は次をご覧ください:
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?