トリアゾリルフェニルグリオキサール試薬:アルギニン誘導型バイオコンジュゲーション
はじめに
化学ライゲーションはバイオテクノロジーや薬物療法における生体高分子の修飾や、機能性材料の開発に利用されています。特にタンパク質の表面の反応性側鎖を修飾できる試薬が広く利用されています。これらの研究では活性エステルと炭酸塩とのリシンへのコンジュゲーション、ハロアセチルやマレイミドのシステインへのコンジュゲーションが多く利用されています。しかし、システイン残基はタンパク質の表面にほとんど存在しないため、変異導入が必要となり、抗体などのタンパク質への還元型システイン残基の導入には複雑なリフォールディングのプロトコルが必要となります。このため、リシンへのコンジュゲーション(およびN末端アミンへのコンジュゲーション)がタンパク質修飾における主要な方法となっています。従って、その他の側鎖と化学選択的に反応させることができれば、複数のプローブや標識によるタンパク質の修飾や、標識分子の分布の識別に有用です。
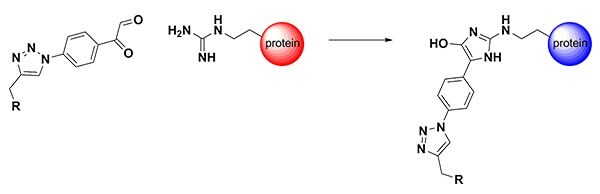
図1.Arginine-Directed Bioconjugation
利点
アルギニンのグアニジル基は正に荷電しているため(pKaは約12)、タンパク質表面に多く存在します。このため、アルギニン残基を選択的・効率的に修飾する試薬を容易に合成できればタンパク質に広く適用できます。アルギニン残基は、ジカルボニル試薬と反応することが知られています。1916年にはOtto Dielsにより隣接カルボニル化合物(例えば、2,3-ブタンジオン)が末端アミジンと選択的に反応することが見出されています1。50年後、ジカルボニル試薬であるフェニルグリオキサールが、アルギニン残基部位でタンパク質を修飾することが示されました2。しかし、これらの反応は単にアルギニン残基を修飾するだけにとどまり、他の機能の導入(ビオチン、蛍光色素分子、PEG、薬物)に関しては幅広い研究は行われてきませんでした。ヒドロキシイミダゾール・コンジュゲーション生成物は加水分解に安定であるため、フェニルグリオキサール基を利用するコンジュゲーションは、多くの医学研究や材料研究に利用できると考えられます。
市販の二官能性フェニルグリオキサール出発原料が存在しないこと、また、合成操作中のジカルボニル基の反応性が高いことが、フェニルグリオキサール・コンジュゲーション試薬の不足理由の一つとなり、アルギニンをターゲットとするより複雑なコンジュゲートの合成を大きく制限していると考えられます。。入手が容易な誘導体のパラアジドフェニルグリオキサール(APG:para-azidophenylglyoxal)は、リボソームの三次構造を確立するための光架橋試薬としてデザインされています3。Sigma-Aldrichでは、この試薬を銅触媒によるアジドとアルキンの環状付加反応に利用しました4。このクリック反応の高い化学的選択性により、フェニルグリオキサール官能基をプローブ分子上に容易に導入できます。この新規のフェニルグリオキサール・コンジュゲーション試薬は、ペプチドやタンパク質分子をアルギニン残基を介して効率的に修飾し、広域な標識と反応性官能基に適用できます5。新たにビオチンおよびCy3蛍光色素を導入できる2種類の標識試薬をカタログに加えました。
主な利用例
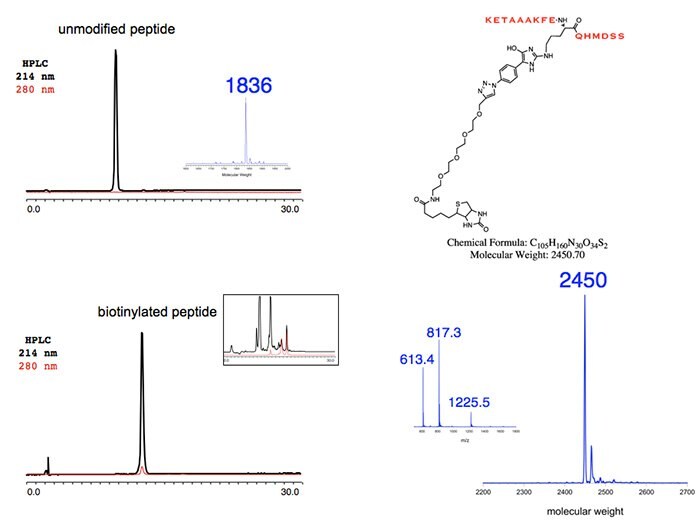
図2.未修飾ペプチド


図3 および 図4主な利用例
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?