- FLAG®ペプチドタグとは?タンパク質の単離・精製への使用方法は?
- 免疫沈降の技術概要
- M2アフィニティーゲルを使用したFLAG®融合タンパク質の免疫沈降(IP)のためのプロトコル
- 少量のFLAG®融合タンパク質の精製
免疫沈降(IP)は、FLAG®ペプチドタグに融合したタンパク質の効率的で高収量な単離・精製法として使用できます。免疫沈降は、アガロースレジンに特異性の高いモノクローナル抗体を共有結合した、ANTI-FLAG®M2アフィニティーゲルでおこないます。アフィニティーレジンは、予備的な条件検討をおこなわずとも、FLAG®-タグ付きタンパク質の効率的な結合が可能です。免疫沈降したFLAG®タグ付き融合タンパク質は、酸性条件下、もしくはFLAG® ペプチドとの競合によって、レジンから効率的に溶出できます。免疫沈降により得られたタンパク質は、サイズ、翻訳後修飾、電気泳動時のゲル相互作用の分析や、活性試験にも使用することができます。
FLAG®ペプチドタグとは何ですか?タンパク質の単離・精製にどのように使いますか?
FLAG® ペプチドは、タンパク質の検出・精製に使用されるマーカーペプチドです。FLAG® タグペプチドは、免疫原性を最大化した8個のアミノ酸(DYKDDDDK)で構成されています。このため、FLAG® 配列に対し生成された高アフィニティーモノクローナル抗体を用いて、FLAG® ペプチドを含むタンパク質を検出・単離することができます。遺伝子組換え技術を用いて、FLAG®マーカーペプチドをタンパク質のN末端、C末端、またはN末端メチオニン残基(Met-FLAG®)に付加したり、タンパク質内部に挿入することができます。
免疫沈降の技術概要
免疫沈降は、以下のステップおよび中間生成体で構成されています:細胞溶解、特異的抗原の抗体への結合、抗体‐抗原複合体、沈降、沈殿物洗浄、免疫複合体からの抗原の解離。
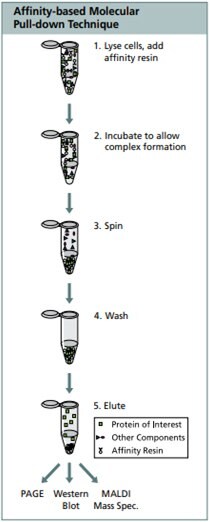
架橋4%アガロースビーズにM2モノクローナル抗体を共有結合させたM2アフィニティーゲルによるFLAG 融合タンパク質の免疫沈降(IP)のためのプロトコル
EZ view red 抗FLAG M2アフィニティーゲル F2426、または抗FLAG M2アフィニティーゲル A2220を使用します。
少量のFLAG 融合タンパク質の精製
注記:免疫沈降には2つのコントロールをおくことが推奨されています
- ポジティブコントロール(FLAG-BAP融合タンパク質、アミノ末端 P7582、カルボキシ末端P7457 またはMet-FLAG-BAP 融合タンパク質 P5975など)
- ネガティブコントロール(タンパク質を含まないブランク)
a)完全に懸濁されるまでアフィニティーゲルビーズを慎重に混和します。広径ピペットチップまたは通常のピペットチップの先端を1 mm切り落としたものを使用して、50%スラリー40 μLを1.5 mLマイクロチューブに速やかに分注します(充てんゲル容量20 μL)。
b)洗浄/ビーズを平衡化します:TBS(50 mM Tris HCl、150 mM NaCl、pH 7.4)500 μLを添加してボルテックスした後に、30~60秒、5,000~8,200 x gで遠心分離します。ビーズを乱さないよう注意して上清を除去します。
c)上記のとおり再度洗浄します。サンプル添加の準備ができるまでチューブを氷上に静置します。注記:複数の免疫沈降サンプルを同時に処理する場合、必要なレジン量をまとめて洗浄することも可能です。各々の洗浄は、総充填ゲル容量の20倍以上の量のTBSを用いておこないます。洗浄後、レジンを必要なサンプル数に分注することもできます。
d)サンプルの調製:
- 遠心分離により細胞ライセートを清澄化します(14,000 x g、10~15分、2~4℃)。
- 必要なライセートの量を算出します。必要量は、トランスフェクションした細胞でのFLAG融合タンパク質の発現レベルにより変わります。
e)結合させます:細胞ライセート200~1,000 μLを添加します(必要に応じ、溶解バッファーを追加して総量1 mLにします[50 mM Tris HCl、pH 7.4、150 mM NaCl、1 mM EDTA、1% Triton X-100])。注記:ライセート容量は、トランスフェクションした細胞でのFLAG融合タンパク質の発現レベルにより変わります。ポジティブコントロールには、TBS 1 mLおよび50 ng/μLのFLAG-BAP融合タンパク質4 μL(約200 ng)を添加します。ネガティブコントロールには、溶解バッファー1 mLのみ添加します。すべてのサンプルおよびコントロールを、ローラーシェーカーまたは回転振とう機を用いて振とうさせながら、約1~2時間、2~8℃でインキュベートします(最大限の結合を得るために、結合ステップを一晩に延長することもできます)。
f)チューブを30秒~1分、5,000~8,200 x gで遠心分離し、上清を除去します(フロースルー)。フロースルーは必要に応じて保存します。
g)ビーズを洗浄します:TBS 500 μLを添加し、ボルテックスした後に30秒~1分、5,000~8,200 x gで遠心分離します。上清を除去します。
h)さらに2回洗浄を繰り返します。
i)サンプルの溶出:3つの溶出方法を実施することができます。この選択は、タグ付きタンパク質の特性や、下流のアプリケーションによって決まります。
- FLAG融合タンパク質は、3X FLAG ペプチド(F4799)を用いた競合法により、ネイティブ条件下で溶出できます。この溶出方法は最も効率的です。
- 0.1 MグリシンHCl、pH 3.5を用いる酸性条件下でも溶出することができます。この溶出法は素早くで効率的ですが、溶出サンプルを速やかに中和する必要があります。
- SDS-PAGEサンプルバッファーを用いて溶出することもできます。この方法を用いると、SDSがM2抗体を変性させるためビーズの再利用ができません。
3X FLAGペプチドを用いた溶出 (F4799)
i. 3X FLAG ペプチドの調製:
- 3X FLAG ペプチドを0.5 M Tris HCl、pH 7.5、1 M NaClに溶解し、濃度 25 μg/μLにします。
- このストック溶液をdiH20で5倍希釈し、濃度5 μg/μLにします。
- さらに5 µg/μLストック溶液の3 μLをTBS 100 μLに添加することで、溶出溶液150 ng/μLを調製します。
ii.3X FLAG溶出溶液100 μLを各サンプルに添加し、穏やかに振とうさせながら30分、2~8℃でインキュベートします。
iii.30秒~1分、5,000~8,200 x gで遠心分離します。上清を新しいチューブに移します。レジンを移さないよう注意します。
1.酸性条件下での溶出(0.1 MグリシンHCl pH -3.5)室温での手順。
i. 各サンプルに0.1 M グリシンHCl、pH 3.5を100 μL添加します。
ii.穏やかに振とうさせながら5~10分、インキュベートします。
iii.30秒~1分、5,000~8,200 x gで遠心分離します。
iv.10 μLの 0.5 M Tris HCl、pH 7.4、1.5 M NaClを入れておいた新しいチューブに上清を移して中和します。
v. サンプルは速やかに使用するか、または-20℃で長期保存します。
2. SDS-PAGEサンプルバッファーを用いた溶出(62.5mM Tris HCl、pH 6.8 および2% SDS、10% (v/v)グリセロールならびに0.002% ブロモフェノールブルー)室温での手順。
注記:抗体の変性を最小限にするため、還元剤は含まれていません (DTTまたは2-メルカプトエタノール)。還元剤を添加すると、固定化M2 抗体から重鎖と軽鎖が解離します(25~50 kDaバンド)。
i. 2Xサンプルバッファー20 μLを各サンプルに添加します。
ii.サンプルを3分間煮沸します。
iii.30秒~1分、5,000~8,200 x gで遠心分離します。
iv.新しいチューブに上清を移します。サンプルはSDS-PAGEにすぐにロードできます。
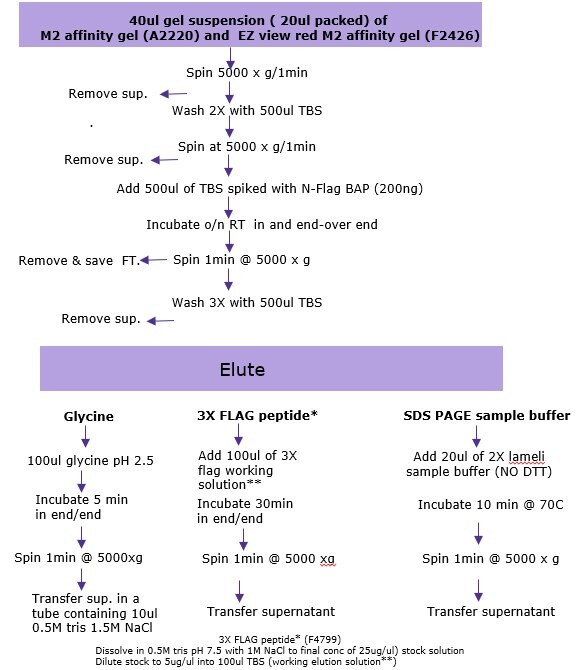
図1.存在量の少ないタンパク質をバッチモードで免疫沈降する際の選択肢の要約
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?