フローサイトメトリーのプロトコルの主なステップ
フローサイトメトリーのアッセイの主なステップには、ささいなことでも結果に大きな影響を及ぼすものがあります。ほとんどのフローサイトメトリーのプロトコルには、以下の4つのステップがあります。
サンプル調製
単細胞懸濁液の調製が可能であれば、どのような細胞集団でもフローサイトメトリーで分析することができます。以下の3点を考慮することが重要です:
- ex vivo細胞集団の調製には、解剖したばかりの組織を機械的な細胞分散法によって穏やかにホモジナイズし、細胞内マトリックス、デブリス、無関係な細胞集団を密度勾配遠心法によって分離し除去します。
- 接着細胞は、酵素やカルシウムキレート剤を用いて、細胞培養容器からはく離することが重要です。
- 浮遊細胞の場合は、計数と生存率の評価以外は必要ありません。
細胞数/力価は、懸濁液中の生細胞を指します。これらは、自動セルカウンターを用い、死細胞/デブリスを除去するゲーティングを適用して測定することができます。別の方法としては、血球計数板とトリパンブルー染色などを用いて、既知の容量中の生細胞数を顕微鏡で計数し、生存率を評価することができます。トリパンブルー色素は、生細胞のインタクトな細胞膜は通過できず、死細胞のみに取り込まれます。
ブロッキング
浮遊細胞への一次抗体の非特異的結合を防ぐために、サンプル動物種に特異的な抗Fc受容体抗体希釈液を添加します。これにより、ほとんどの細胞タイプに存在するFc受容体と抗体の定常部位のFcが結合するのを防ぎます。通常は少量のFcブロックを洗浄した細胞に加えます。染色用の抗体希釈液は、ブロッキングインキュベーションの終了時に、洗浄ステップを行わずに直ちに添加します。これにより、非特異的抗体結合のブロッキングが全体を通して確実に維持されます。
抗体インキュベーション
一次抗体のインキュベーション
免疫組織染色などの他の抗体アプリケーションとは異なり、フローサイトメトリーにおける抗体の希釈は、バッファー容量あたりの抗体量ではなく、サンプル中の細胞数あたりの抗体量に基づくのが一般的です。最適濃度は、他のアプリケーションと同様に、経験的に決める必要があります。抗体はフローサイトメトリーのアッセイバッファーで希釈できます。少容量で染色(一次抗体処理)することにより、懸濁液中の細胞への抗体の到達が向上します。抗体処理の終了時には、細胞を染色バッファーまたはアッセイバッファーで3回以上洗浄し、結合しなかった一次抗体を除去してください。
二次抗体のインキュベーション
間接検出法を用いる場合には、一次抗体インキュベーションの後に、使用した各一次抗体のアイソタイプに特異的な二次抗体を適切に希釈したものとインキュベーションします。マルチカラー検出実験では、各ターゲットからのシグナルを識別可能にするために、各二次抗体について波長や色が十分に異なる蛍光プローブを選定しなければなりません。二次抗体とのインキュベーションは、光に敏感な蛍光プローブを保護するために暗所で行ってください。サンプルは氷上で維持し、4℃で遠心分離します。
蛍光色素
フローサイトメトリーで用いられる多くの抗体は、蛍光色素で直接標識されています。しかし、多くの非標識の一次抗体も、標識した二次抗体と組み合わせて日常的に用いられています。フローサイトメトリーにおいて用いられることが最も多い2種類の蛍光色素は、フルオレセインイソチオシアネート(FITC)とフィコエリトリン(PE)です。これらの色素は、いずれも488 nmレーザーで励起されますが、発光スペクトがFITCは530 nm(緑色)、PEは570~575 nm(オレンジ色)と異なるため好まれています。蛍光色素の化学的理解やフローサイトメトリー装置の進歩によって、この2種類の色素以外でも複数の細胞の標識や選別を同時に行うことが可能となっています。

図1.各種蛍光プローブの励起および発光波長のFluoroFinder® Spectra Viewerのグラフ。左から順番に、mFluor 450、Alexa Fluor 488、PE、APC、iFluor 700、およびiFluor 750。
どのようなフローサイトメトリー実験であっても、分析できる変数の最大数は利用できる光源と検出器の数に基づきます。複数のレーザーを備えたフローサイトメーターでは、励起スペクトルの異なる蛍光プローブを同時に使用することが可能なため、使用できる抗体の数を増やすことができます。さらに、レーザーを並列に配置した装置では、各レーザーによって順番に粒子が励起されて単一粒子からの異なる発光シグナルを収集できるため、複数のレーザーを複数のチャネルと組み合わせることで、励起スペクトルが異なり発光スペクトルが類似した2つの蛍光プローブ間の識別も可能になります。
適切な蛍光色素を選択するためのヒント:
- ご使用の装置構成で最も明るい蛍光色素のセットを選択してください。
- 装置構成に応じて、スペクトルの重複が最小になる蛍光色素を選択してください。
- 抗原の発現量が低い抗体には最も明るい蛍光色素を選択し、抗原発現量が高い抗体には最も暗い蛍光色素を適用してください。
- 高感度を要する検出器には、明るい細胞集団からのスピルオーバーが入らないようにしてください。
- タンデム色素の劣化を避け、結果への影響を考慮してください。
フローサイトメトリー実験に適した抗体はAntibody Explorer抗体検索でお探しください。
固定および保存
表面抗原の染色が完了した後、データの取得のために再懸濁する代わりに、細胞をパラホルムアルデヒドを含むリン酸緩衝食塩水で固定する場合があります。こうすると細胞を4℃でオーバーナイト保存することが可能となるため、染色後すぐにサンプルのデータの取得を行うことができない場合に有用です。その後、固定剤を希釈し、細胞を少なくとも2回洗浄する必要があります。染色直後のデータの取得が推奨されますが、4℃で遮光した状態で保存された固定細胞は、固定後48時間までであればデータの取得が可能です。
細胞内のターゲット:細胞透過処理
対象のタンパク質が細胞内にある場合には、表面染色後に細胞を固定し、構造強度を高めます。こうすると、抗体が細胞内の抗原に到達できるようにするために必要な透過処理に、細胞が耐えられるようになります。固定・洗浄した細胞は、適切な界面活性剤を含有するリン酸緩衝食塩水中で、室温で15分以内のインキュベーションをし、透過処理を行います。その後、界面活性剤溶液を希釈し、1回洗浄します。サポニンなどの非イオン性界面活性剤が推奨されています。透過処理は、抗体やストレプトアビジンを用いるすべてのステップを通して維持されなければなりません。このため、その後の染色処理を通して、蛍光プローブとのインキュベーションステップが完了するまで、界面活性剤を染色バッファーに入れるようにします。フローサイトメトリーによる細胞内抗原の検出のその他の手順については、前述の原則や手順に従います。直接検出法、間接検出法、またはシグナル増幅を伴う直接/間接検出法が使用可能です。
データの取得
最新のフローサイトメーターには、各細胞が検出器を通過する際に粒子の特性に基づき生じるシグナルを取得し、変換するために必要なソフトウェアが付いています。また、これらのソフトウェアプログラムには、実験の構築を補助するコンポーネントが含まれていることが多く、これは複数の検体からさまざまなサンプルを解析する場合に特に重要となります。
マルチカラー実験では、実験で用いる各種蛍光プローブのスペクトルの波長の重複を考慮し、蛍光補正パラメータの設定をすることが重要となります。蛍光補正では、各蛍光プローブのスペクトルを校正し、スペクトルの重複による近接したチャネルからのシグナルを減算します。

図2.この2パラメータフローサイトメトリープロットは、細胞の光散乱特性を用いて対象の細胞集団を検出する方法を示している。ここでは、サイズ(前方散乱光)と細胞内の複雑性(側方散乱光)を用いている。その後、ユーザーが設定・適用するゲートや領域を用いて、解析の焦点を合わせるために対象の亜集団を検出する(ここでは、赤色の楕円形で可能性のある生細胞集団を表している)。
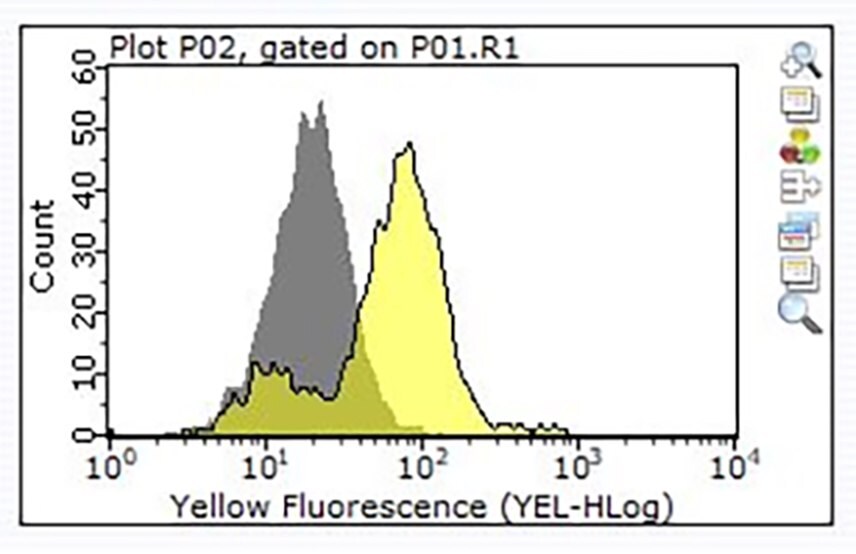
図3.100万個のRaji細胞を、1 μgのカタログ番号ZRB1564 抗CD24クローン 3N22 ZooMAb®ウサギモノクローナル抗体(黄色のヒストグラム)または同量のウサギIgGアイソタイプコントロール(灰色のヒストグラム)をインキュベート後、PE標識ロバ抗ウサギIgG二次抗体を用いて染色した。
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?