免疫療法を受けている転移性NSCLC患者の血清中の可溶性免疫チェックポイント分子のマルチプレックス評価
肺がんは、世界中のがん関連死の主な原因になっていますが、これは一つにはがんが広範囲に広がってしまってから発見されるという診断の遅れに起因します。PD-1/PD-L1を標的とする免疫チェックポイント阻害療法は、優れた持続的な臨床効果と低い毒性プロファイルにより、がん患者におけるがん治療と生存率を大きく変えました。しかし、この治療法も完全ではなく、この治療法の恩恵を受けることができるのは一部の患者のみです。複数のほかの免疫チェックポイントシステムが治療の選択肢として期待できると報告されていますが、肺がんに対する効果はまだ明らかになっていません。
本研究では、 MILLIPLEX® Human Immuno-Oncology Checkpoint Protein Panel 2を用いて、PD-1/PD-L1標的治療を受けている進行期非小細胞肺がん患者123名から採取した治療前血清における、可溶性チェックポイント分子と免疫制御因子からなる31種類の免疫チェックポイント分子のプロファイリングを行いました。
これらの分子の動態や臨床結果との関連性を解明できれば、新しい免疫チェックポイント阻害療法の研究推進に役立つ可能性があります。血清中の可溶性免疫チェックポイント分子の評価研究は、PD-1/PD-L1免疫療法が有効な患者の特定や、今後の免疫療法研究の新しいターゲットの発見に役立ちます。
がん免疫療法における免疫チェックポイントの役割
免疫系は、腫瘍の増殖と進行を促進または抑制する可能性を持つ、腫瘍生物学の重要な制御因子です1。がんに対する免疫系の活用は、がん研究におけるいくつかの治療アプローチの焦点となっています。免疫チェックポイント阻害剤(ICI)は、免疫チェックポイント制御分子が受け取る抑制シグナルを阻害するように設計された治療用モノクローナル抗体で、転移性黒色腫、非小細胞肺がん(NSCLC)、その他の腫瘍患者の一部に対して長期生存の効果を示しています2-4。しかし、ICIに対する反応はすべての腫瘍で同一ではなく、がんにおける免疫制御機構の多様性が示唆されています5。例えば、同じ腫瘍に複数の免疫チェックポイント分子が共存することは、がん免疫療法の課題であり、治療抵抗性や治療の失敗に繋がる可能性があります6。したがって、これらの抵抗性メカニズムを解明できれば、現行の治療法に有効な患者の選択が容易になり、将来の研究の新しい治療ターゲットの発見に繋がるかもしれません。
免疫チェックポイント分子は、主にT細胞などの免疫細胞に発現する細胞表面タンパク質で、腫瘍抗原を含むさまざまな抗原による免疫活性化を制御しています。免疫療法薬は、抗原提示細胞との相互作用によるT細胞活性化の阻害機構を働かないようにし、本来備わっている腫瘍抗原に対する免疫応答を利用するものです7。
NSCLCにおけるPD-1/PD-L1パスウェイ
PD-1(Programmed death receptor-1)とそのリガンド(PD-L1)は、現行の免疫療法薬の主要なターゲットで、肺がんの最も一般的なサブタイプNSCLCに対して承認されています。しかし、その他の多くの免疫チェックポイント分子の機能や潜在的な治療的価値は完全には解明されていません。
NSCLCは、世界のがんによる死因の上位を占めており、特に進行期において免疫チェックポイント阻害療法の恩恵を受けている二番目のがんです8, 9。PD-1/PD-L1免疫チェックポイントパスウェイを標的とする免疫療法薬は、一連の臨床試験で優れた臨床効果が示されたため、瞬く間に進行期NSCLCの標準治療に組み込まれるようになりました。しかし、これらの患者に対する全体的な奏効率はまだ低く、代替の免疫チェックポイント分子が発現するなど、複数の抵抗性メカニズムが出現し始めています。
ここでは、免疫療法を受けている患者を対象に31 種類の可溶性免疫チェックポイント分子の循環血液中濃度を評価しました。また、その濃度と患者の臨床結果を相関させることで、NSCLC における代替ICI 機構の関与の可能性を検討しました。
方法
患者のサンプル集団
血清は、プラチナ製剤との2剤併用化学療法が奏功しなかった進行期NSCLC(IIIb-IV)患者123名から、PD-1/PD-L1標的免疫療法(例:ニボルマブ、アテゾリズマブ、ペムブロリズマブ、またはデュルバルマブ)を開始する前に採取しました。臨床データは、各被験者から書面によるインフォームドコンセントを取得した後、Rush University Cancer Center(RUCC)Biorepositoryによって収集されました。臨床結果は、免疫療法薬の初回投与日から起算し、次のように算出しました。
- 無増悪生存期間(PFS)は、治療開始日から腫瘍進行を初めて確認した日までの期間
- 全生存期間(OS)は、治療開始日から死亡日、または患者の生存が最後に確認できた日までの期間
今回の研究で用いた治験実施計画書はすべて、Rush University Medical Center(RUMC)の治験審査委員会の承認を得ました。
血清の採取および保存
PD-1/PD-L1標的療法の開始直前に、末梢血を10 mL赤栓付Vacutainers™に採取し、標準の臨床検査法にて処理しました。MILLIPLEX®イムノアッセイを用いたタンパク質バイオマーカー評価に使用される各血清の分注サンプルには、処理後のタンパク質分解を最小限に抑えるために、25 μL/mLのMammalian Protease Inhibitor Cocktailおよび10 μL/mL の0.5 M EDTAを添加しました。分注サンプルは、試験を行うまで-80℃で保存し、2回を超える凍結融解を行いませんでした。
血清中がん免疫バイオマーカー濃度の測定
MILLIPLEX® Human Immuno-Oncology Checkpoint Protein Panel 2を用いて、血清サンプル中の31種類の可溶性免疫チェックポイント分子および免疫制御因子を評価しました。本パネルは研究用で、診断目的では使用できません。本パネルは下記のターゲットで構成されています。
|
|
すべての主要データは、Luminex® FLEXMAP 3D™システムにて取得しました。アナライトの濃度は、5変数近似アルゴリズム(xPONENT™ v4.0.3 Luminex Corp., Austin, TX)を用いて、7点標準曲線からを算出しました。すべてのデータは、キットのプロトコルで定義されるクオリティーコントロールの最小閾値を満たしています。
バイオマーカー統計解析法
生存パラメータのカットオフ値は、R program version 3.4.の「survminer」パッケージを用いて決定しました。ベースラインのバイオマーカーと臨床結果の関連性は、Graphpad ver. 8.3を用いたログランク検定およびカプラン・マイヤー法により算出し、p値0.05未満を統計的有意と見なしました。
マルチプレックス評価結果
解析性能
MILLIPLEX® Human Immuno-Oncology Checkpoint Protein Panel 2を用いて、進行期NSCLCの治療前の血清サンプル中の免疫制御関連アナライトを定量しました。アッセイは、3~4 logの広いダイナミックレンジで実施されました。精度は平均94%で、サンプルと標準曲線との高い一致が見られました。表1にレプリケート間のアッセイ内(intra-assay)精度を平均%CV(変動計数)で示しています。
表1.レプリケート間のアッセイ内(intra-assay)精度(平均%CV)。標準曲線、サンプル、およびキットのクオリティーコントロール(QC)のレプリケート間の変動係数(CV)
患者コホートでの性能:無増悪生存期間(PFS)
対象コホートにおいて、ベースラインの可溶性免疫チェックポイント分子と臨床結果との間に有意な相関が認められました。CD40L、B7-H2/ICOSL、APRIL、B7-H5/VISTA、E-Cadherin、Galectin-1、Galectin-3、IDO1、Nectin-2、OX40/CD134、Perforinのベースラインの高血中濃度は、無増悪生存期間を有意に延長しました(p<0.05)。免疫チェックポイント分子のカプラン・マイヤー曲線とカットオフ値を図1に示しています。
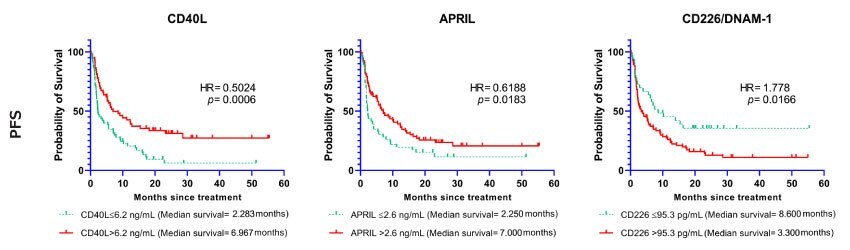
図1.無増悪生存期間に関連する可溶性免疫チェックポイント分子(CD40L、APRIL、CD226/DNAM-1)。バイオマーカーと無増悪生存期間(PFS)との関連性を示すカプラン・マイヤー曲線。マーカーのベースラインがカットオフ値より上または以下の症例の生存曲線。
ハザード比および95%信頼区間(CI)の詳細結果を表2に示します。
表2:可溶性免疫チェックポイント分子と無増悪生存期間の関連。解析結果と無増悪生存期間(PFS)との関連性:最適化カットオフ値、カットオフ値以下の症例数(「N≤」)およびカットオフ値を上回る症例数(「N>」)、カットオフ値以下の症例のPFS中央値(「LOW」)およびカットオフ値を上回る症例のPFS中央値(「HIGH」)、ならびにログランク検定のp値。ハザード比(HR)および95%信頼区間(CI)を示す。
患者コホートでの性能:全生存期間
バイオマーカーの多くが全生存期間の結果に関連しました。CD40L、B7-H2/ICOSL、APRIL、B7-H5/VISTA、E-Cadherin、Galectin-1、Galectin-3、Granulysin、Nectin-2、OX40/ CD134、Perforinのベースラインの高値は全生存期間の延長に関連しました(すべてp<0.05)。7-H3/CD276、5'-NT/CD73、CD226/DNAM-1、FGL1/Hepassocin、MICA、PVR/CD155、Siglec-7のベースラインの低値は全生存期間の短縮に関連しました(すべてp<0.05)。ハザード比および信頼区間(95% CI)の詳細結果を表3に示します。
表3:可溶性免疫チェックポイント分子と全生存期間の関連。解析結果と全生存期間(OS)との関連性:最適化カットオフ値、カットオフ値以下の症例数(「N≤」)およびカットオフ値を上回る症例数(「N>」)、カットオフ値以下の症例のPFS中央値(「LOW」)およびカットオフ値を上回る症例のPFS中央値(「HIGH」)、ならびにログランク検定p値。ハザード比(HR)および95%信頼区間(CI)を示す。
図2に、免疫チェックポイント分子のベースラインカットオフ値と全生存期間のカプラン・マイヤー曲線を示します。
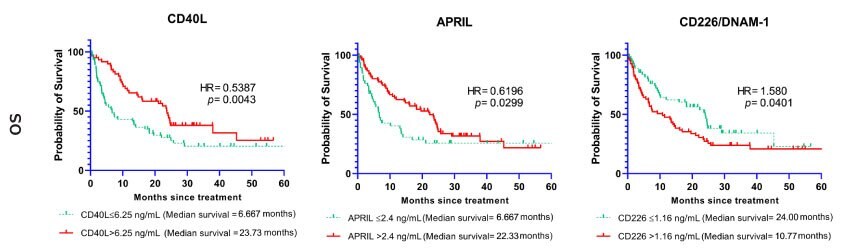
図2.全生存期間に関連する可溶性免疫チェックポイント分子(CD40L、APRIL、CD226/DNAM-1)。バイオマーカーと全生存期間(OS)との関連性を示すカプラン・マイヤー曲線。マーカーのベースラインがカットオフ値より上または以下の症例の生存曲線。
結論
可溶性免疫チェックポイント分子は、MILLIPLEX® Human Immuno-Oncology Checkpoint Protein Panel 2を用いてマルチプレックスにより評価できます。さらに、PD-1/PD-L1標的療法を受けているNSCLC患者から採取したサンプルで、循環血液中免疫チェックポイント分子と治療の反応パターンとの間に有意な関連性があることが明らかになりました。
この研究は、米国イリノイ州シカゴのRush University Medical Centerで行われました。(データ提供:Imad Tarhoni, M.D., Ph.D., Cristina L. Fhied, M.S., David Gerard, M.S., Jeffrey A. Borgia, Ph.D. Department of Cell & Molecular Medicine, Pathology, and the Rush Biomarker Development Core in 2020)
Vacutainers™は、Becton, Dickinson, and Company社の商標です。
研究目的での使用に限定されます。診断目的では使用しないでください。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?