mAb・遺伝子組換えタンパク質の受託試験・開発・製造サービス

バイオ医薬品開発を加速
メルクのMillipore®CTDMOサービスでは、モノクローナル抗体、二重特異性抗体、融合タンパク質、抗体フラグメント の開発・製造の全段階にわたり深い専門知識と柔軟なソリューションをご提供します。上市までの過程においてリスクのバランスを取り、スピードを最適化し、規制コンプライアンスのあらゆる側面でサポートするために、お客様と連携します。
メルクのサービスは、哺乳類の細胞株やプロセス開発から、培地・フィードのスクリーニング、マスターセルバンク製造、スケールアップ、そしてGMP臨床用・商用原薬まで網羅しています。さらに、メルクの分析法開発・バリデーション・試験は社内で実施しております。
実績
35年以上
プロセス開発の経験年数
25年以上
GMP製造における経験年数
10年以上
柔軟なシングルユース製造における経験年数
85以上
過去10年間にリリースしてきたGMPバッチ数

製品開発
細胞株開発
目的の遺伝子を発現する細胞株の設計は、前臨床開発における重要なステップです。お客様の細胞株が前臨床から商用規模までにわたり確実に高品質なタンパク質を産生しているようにするサポートをします。メルク独自のCHOZN® 細胞株開発プラットフォームでは、高生産性クローンを迅速かつ簡単に選択し、スケールアップすることができます。
細胞株開発の能力と専門知識を十分に有しています。DNAやベクターコンストラクトから最適なクローンの選択、研究用セルバンクとマスターセルバンクの製造、および安定性試験の実施が可能です。
初期プロセス開発
お客様が細胞株からアップストリーム・ダウンストリームプロセス開発に移行するに合わせて、現在と未来の成功をもたらす頑健でスケーラブルなプロセスを構築するお手伝いをします。常にプロセスの加速を目指しながら、お客様がIND/IMPD申請のための品質、安全性、規制に関する要件を満たすサポートをします。
迅速mAb開発プログラム – トランスフェクションからGMP原薬までが9ヶ月
メルクの迅速mAb開発プログラムでは、段階に適したコスト効率の実績のあるプロセスを用いてIgG1・IgG4モノクローナル抗体の開発スケジュールを9ヶ月まで短縮できます。このプログラムでは、CMC・規制関連要件における深い専門知識と共に、mAbの開発とプロセス知識、継続的イノベーション、高品質基準、リスク軽減における35年を超える経験が生かされています。
開発後期のプロセス最適化、スケーリング、バリデーション
お客様がバイオ医薬品の商用製造に移行するに伴い、製造への準備に役立つ開発後期機能をご提供します。さまざまな専門分野に精通したメルクのチームには、GMP製造において25年以上の経験があります。メルクは、お客様に製造プロセスを適応、規模調整、バリデーションして市場需要を満たしていただけるように、技術、機器、エキスパートによる相談をご提供しています。

製造
臨床用原薬の製造
さまざまな専門分野に精通したメルクのチームには、多種多様な生物製剤分子を30年以上にわたり取り扱ってきた経験があり、お客様に信頼していただける技術、機器、エキスパートによる相談をご提供しています。2012年以降は、シングルユース技術を利用して200 Lから2,000 Lのスケールのパイロット・GMPバッチを製造し、85を超えるGMPバッチをリリースしてきました。
商用原薬の製造
メルクでは、フランスのマルティヤックにある商用施設から商用原薬を世界中に供給しています。メルクのCMC、規制、品質の専属エキスパートが、日常的な大規模製造や小規模製造の臨床から商用製造までの連続性をもたらします。
完全に統合されたCTDMOパートナーとして、メルクは以下を提供しています。
- 直接的で効率的な技術移管
- バリデーション専門知識
- CMC・規制関連サポート
- シングルユース機器に関する知識
- 専属の製造科学・技術チーム
- 統合型バリューチェーン

品質・規制関連サービス
メルクは、開発の極めて初期段階から、分析法開発と並行してデータの収集、バリデーション、記録を行うことにより、製品品質とプロセス堅牢性を支えています。
品質・CMC規制関連サポート
- 堅牢な品質管理システム
- GMP準拠の品質保証
- 医薬品開発・製造のためのCMC規制関連サポート
- 初期申請から承認後・ライフサイクルマネジメントまでのCMC規制関連サポート
- コモン・テクニカル・ドキュメントへの情報の書式設定
分析法の開発
- セルバンクの特性評価
- 分析法の開発、実施、バリデーション
- 工程内管理試験
- 質量分析機能
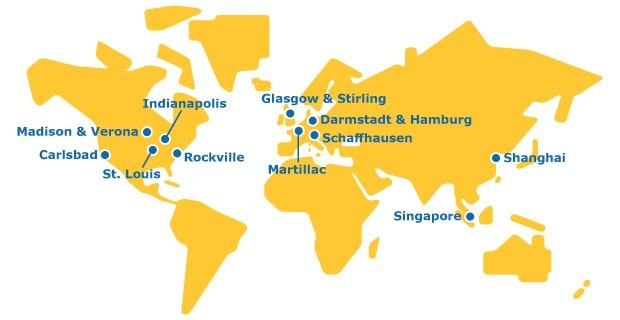
グローバルフットプリント
メルクは、グローバルネットワークにより製品ごとのバリューチェーンの全段階にわたって試験サービスを提供する、唯一の組織です。
モノクローナル抗体、二重特異性抗体、融合タンパク質、抗体フラグメントの開発・製造のためのスピード、スケーラビリティ、品質、柔軟性を確保するために密接に連携したCDMOネットワーク

上海施設は、当社の中国バイオ医薬品試験センターに所在し、ウイルスクリアランス試験を提供しています。前臨床開発から国内用と輸出用の製品の商用化段階まで、中国国内でウイルスクリアランス試験を実施していただくことができます。

メルクのマルティヤック施設は1987年の設立以来、プロセス開発ならびに200 Lまでのパイロット製造と2,000 Lまでの商用製造に対応した完全統合型施設となりました。

バイオセーフティー試験および製造サービスは、前臨床開発段階から商用生産まで製品サイクル全体をカバーします。提供するサービスには、分析法の開発、セルバンク製造、特性評価、ウイルスクリアランス試験、原薬・製剤のリリース試験に加え、迅速検出試験が含まれます。
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?