おすすめの製品
由来生物
mouse
品質水準
抗体製品の状態
purified immunoglobulin
抗体製品タイプ
primary antibodies
クローン
RL2, monoclonal
化学種の反応性(ホモロジーによる予測)
all
テクニック
affinity binding assay: suitable
electron microscopy: suitable
immunocytochemistry: suitable
immunoprecipitation (IP): suitable
western blot: suitable
アイソタイプ
IgG1κ
輸送温度
wet ice
ターゲットの翻訳後修飾
unmodified
遺伝子情報
human ... OGT(8473)
詳細
β-結合N-アセチルグルコサミン(β-GlcNAc)によるセリンまたはトレオニン残基のヒドロキシル部分を介したタンパク質の翻訳後修飾は、O-結合β-GlcNAcまたは単にO-GlcNAcと呼ばれます。O-GlcNAcは、すべての動植物の核細胞質画分に含まれる最も多い翻訳後修飾の一つです。O-GlcNAcは他のタイプのタンパク質糖化とは異なり、核画分と細胞質画分の中でのみ生じ、通常はさらに修飾されてより伸長した構造を形成することがありません。また、O-GlcNアシル化は高度に動的で可逆的なプロセスです。O-GlcNAcトランスフェラーゼ(OGT)は特定のセリンまたはトレオニン残基でO-GlcNAcをタンパク質に付着させ、O-GlcNAcaseはタンパク質からのO-GlcNAcの除去/加水分解を触媒します。実際に、O-GlcNアシル化とセリン/トレオニンリン酸化の間の活発な相互作用は、細胞シグナル伝達の調節において重要な役割を果たします。タウおよびRNAポリメラーゼII(Pol II)は、O-GlcNアシル化による修飾を受けることがよく知られる2つのタンパク質です。アルツハイマー病ヒト脳では、タウが広範囲にわたってリン酸化され、あまりO-GlcNアシル化されません。同様に、転写の伸長段階が始まると、ポリII CTDではO-GlcNAcが除去されてO-リン酸塩に入れ替わります。
特異性
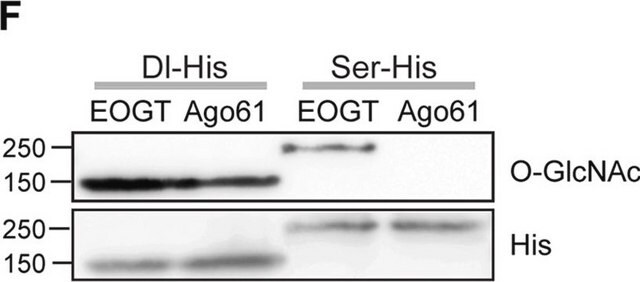
O-GlcNAc化タンパク質およびペプチド上のO-結合N-アセチルグルコサミン(O-GlcNAc)部分を特異的に認識します。遊離のGIcNAcに対してはほとんど反応せず、GalNacに対しても反応しません。O-GlcNAc化タンパク質をガラクトース転移酵素で処理すると、1-4結合を介してO-GlcNAcがガラクトース化され、クローンRL2による結合は完全に失われます(Holt, G.D., et al. (1987).J. Cell Biol. 104(5):1157-1164)。
標的となる構造は、種特異的ではありません。
免疫原
ラットO-結合型N-アセチルグルコサミンに相当するラット肝核膜から精製した細孔複合体-ラミナ画分。
アプリケーション
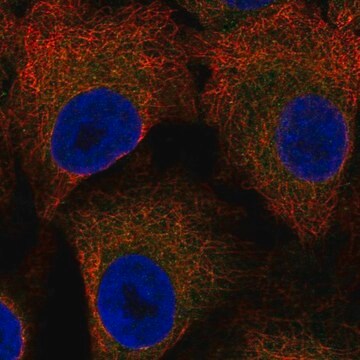
免疫細胞染色:4.0 µg/mLで使用、HeLa細胞でO-結合N-アセチルグルコサミンを検出できます。
免疫細胞染色:ジギトニン透過処理したHeLa細胞の核膜を免疫染色しましたが、核内部は免疫染色しませんでした。クローンRL2は、無傷の核膜がないTriton X-100透過処理したHeLa細胞の核内部のみを染色しました(Adam, S.A., et al. (1990).J. Cell Biol. 111(3):807-816)。
アフィニティー結合分析:125Iで放射性標識し、分離したラット肝核膜に対して結合特性が検討されました。(Snow, C.M., et al. (1987).J. Cell Biol. 104(5):1143-1156)。.
電子顕微鏡:分離したラット肝核膜においてO-GlcNAc免疫反応により局在が調べられました(Snow, C.M., et al. (1987).J. Cell Biol. 104(5):1143-1156)。
ウェスタンブロッティング:ラット肝臓の核膜調製物からO-GlcNAc化タンパク質を検出できました(Snow, C.M., et al. (1987).J. Cell Biol. 104(5):1143-1156; Holt, G.D., et al. (1987).J. Cell Biol. 104(5):1157-1164)。
免疫沈降:ラット肝臓の核膜の可溶化調製物からO-GlcNAc化タンパク質を免疫沈降できます。核膜調製物をガラクトシルトランスフェラーゼで前処理すると、クローンRL2による糖タンパク質の免疫沈降が阻害されました(Snow, C.M., et al. (1987).J. Cell Biol. 104(5):1143-1156; Holt, G.D., et al. (1987).J. Cell Biol. 104(5):1157-1164)。
免疫細胞染色:ジギトニン透過処理したHeLa細胞の核膜を免疫染色しましたが、核内部は免疫染色しませんでした。クローンRL2は、無傷の核膜がないTriton X-100透過処理したHeLa細胞の核内部のみを染色しました(Adam, S.A., et al. (1990).J. Cell Biol. 111(3):807-816)。
アフィニティー結合分析:125Iで放射性標識し、分離したラット肝核膜に対して結合特性が検討されました。(Snow, C.M., et al. (1987).J. Cell Biol. 104(5):1143-1156)。.
電子顕微鏡:分離したラット肝核膜においてO-GlcNAc免疫反応により局在が調べられました(Snow, C.M., et al. (1987).J. Cell Biol. 104(5):1143-1156)。
ウェスタンブロッティング:ラット肝臓の核膜調製物からO-GlcNAc化タンパク質を検出できました(Snow, C.M., et al. (1987).J. Cell Biol. 104(5):1143-1156; Holt, G.D., et al. (1987).J. Cell Biol. 104(5):1157-1164)。
免疫沈降:ラット肝臓の核膜の可溶化調製物からO-GlcNAc化タンパク質を免疫沈降できます。核膜調製物をガラクトシルトランスフェラーゼで前処理すると、クローンRL2による糖タンパク質の免疫沈降が阻害されました(Snow, C.M., et al. (1987).J. Cell Biol. 104(5):1143-1156; Holt, G.D., et al. (1987).J. Cell Biol. 104(5):1157-1164)。
抗O-結合型N-アセチルグルコサミン抗体クローンRL2はO-結合型N-アセチルグルコサミンに対する抗体であり、ウェスタンブロッティング、免疫細胞染色、アフィニティー結合分析、電子顕微鏡、免疫沈降で使用できます。
品質
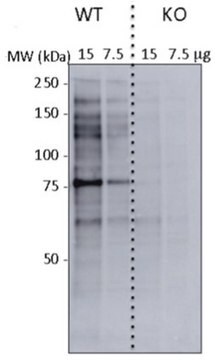
HeLa細胞ライセートでウェスタンブロッティングにより評価。
ウェスタンブロッティング:1.0 µg/mLで使用、10 µgのHeLa細胞ライセート中のO-結合N-アセチルグルコサミンを検出できます。
ウェスタンブロッティング:1.0 µg/mLで使用、10 µgのHeLa細胞ライセート中のO-結合N-アセチルグルコサミンを検出できます。
ターゲットの説明
O-GlcNアシル化タンパク質のサイズによって異なります。
物理的形状
フォーマット:精製
その他情報
濃度:ロットに固有のデータシートを参照してください。
Not finding the right product?
Try our 製品選択ツール.
保管分類コード
12 - Non Combustible Liquids
WGK
WGK 1
引火点(°F)
Not applicable
引火点(℃)
Not applicable
適用法令
試験研究用途を考慮した関連法令を主に挙げております。化学物質以外については、一部の情報のみ提供しています。 製品を安全かつ合法的に使用することは、使用者の義務です。最新情報により修正される場合があります。WEBの反映には時間を要することがあるため、適宜SDSをご参照ください。
Jan Code
MABS157:
試験成績書(COA)
製品のロット番号・バッチ番号を入力して、試験成績書(COA) を検索できます。ロット番号・バッチ番号は、製品ラベルに「Lot」または「Batch」に続いて記載されています。
Monoclonal antibodies identify a group of nuclear pore complex glycoproteins.
Snow, CM; Senior, A; Gerace, L
The Journal of cell biology null
Nuclear protein import in permeabilized mammalian cells requires soluble cytoplasmic factors.
Adam, SA; Marr, RS; Gerace, L
The Journal of cell biology null
Nuclear pore complex glycoproteins contain cytoplasmically disposed O-linked N-acetylglucosamine.
Holt, GD; Snow, CM; Senior, A; Haltiwanger, RS; Gerace, L; Hart, GW
The Journal of cell biology null
Jin-Wei Jhu et al.
International journal of molecular sciences, 22(18) (2021-09-29)
Glutamine and lipids are two important components of proliferating cancer cells. Studies have demonstrated that glutamine synthetase (GS) boosts glutamine-dependent anabolic processes for nucleotide and protein synthesis, but the role of GS in regulating lipogenesis remains unclear. This study identified
Ilaria Zuliani et al.
International journal of molecular sciences, 22(7) (2021-05-01)
The disturbance of protein O-GlcNAcylation is emerging as a possible link between altered brain metabolism and the progression of neurodegeneration. As observed in brains with Alzheimer's disease (AD), flaws of the cerebral glucose uptake translate into reduced protein O-GlcNAcylation, which
ライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)