サポートのためのサービス
お客様のブレイクスルーのために。お客様のマイルストーンのために。お客様をサポートいたします。
Millipore®受託試験・開発・製造(CTDMO)サービス
Millipore® CTDMOサービスでは、ひとつのパートナーとの合理化された体験を提供することで、医薬品のライフサイクルにわたる複数のベンダー、サプライチェーンへのニーズ、煩雑な優先順位の管理という負担を軽減します。メルクは、唯一の経験豊富なパートナーとして、前臨床から商用化までの開発、製造、受託試験、および技術における専門知識を組み合わせて、お客様のマイルストーンとブレイクスルーを加速します。
メルクは、自社の供給網に沿った医薬品開発、材料科学、プロセス技術に関する30年以上の世界的な成功を活用して、お客様のプログラムを加速させます。
私たちは業界で高い評価を得ており、顧客志向のサービスを提供します。
統合化された試験で利点を実感
メルクのCTDMOサービスは、バリューチェーン全体に対応する、統合され簡素化された体験を提供しており、お客様の創薬プロセスにわたる信頼いただけるパートナーです。受託試験サービスは、CTDMOサービスのモダリティに組み込まれており、医薬品開発のプロセスの効率化を推進します。私たちの専門知識、スピード、および機敏性が、お客様の革新的イノベーションに違いをもたらします。
私たちが提供する価値
深い専門知識と幅広いポートフォリオ – 新たな業界水準を生み出すイノベーションとテンプレート開発で医薬品業界を前進させます。
製造と試験の能力がもたらす柔軟性 – 業界の複雑なサプライチェーンのニーズに対応する性能と能力向上にむけた多大な投資を行っています。
長年の経験に基づき、お客様に有用な情報を提供し、承認までの道を共にサポートいたします。世界各国の規制に関する私たちのノウハウにより、高い品質基準と規制コンプライアンスが確実なものになります。
モダリティにわたる明確なリーダーシップ

ADC・バイオコンジュゲーション
抗体薬物複合体(ADC)では、正確なデザインと特化された専門知識の組み合わせが必要で、すべてが迅速に提供されることが求められます。受託開発・製造で15年以上の経験がある私たちは、高薬理活性化合物の取り扱いに特化された施設でのモノクローナル抗体(mAb)への薬物リンカーの結合における最先端の専門知識で評価されています。

mAb・r-タンパク質
モノクローナル抗体、二重特異性抗体、ADC、融合タンパク質など生体分子の種類にかかわらず、頑健なスケーラブルプロセスを構築するお手伝いをして、現在と未来の成功を確実にします。メルクの大規模GMP施設と260を超える生物製剤で、実績のあるスケールアップ成功率を誇る経験豊富な私たちにお任せいただけます。

mRNA製造・LNP製剤
mRNAを取り巻く状況は急激に変化しており、お客様は役に立つ分子を得るための最新技術と新たな治療法を必要としています。市場で最も包括的なmRNAバリューチェーンと統合サービスを提供し、mRNAから脂質添加剤、そしてLNP製剤まであらゆる段階でお客様をサポートしています。

低分子化合物
患者に大きな影響をもたらす低分子化合物メルクでは、さまざまな形態の低分子を取り扱うお客様にコンサルティングパートナーサービスをご提供しています。APIからHPAPI、PEG、ADCリンカーやペイロード、標的タンパク質分解から新規フォーマットの複合体まで、メルクの数十年にわたる経験により、商用化までの複雑さとリスクが軽減します。

ウイルスベクター製剤(VV)
アデノ随伴ウイルス、レンチウイルス、アデノウイルスなどのウイルスベクターでのメルクの経験により、遺伝子・細胞治療薬の開発・製造を効率的に行うことができるようになります。25年以上にわたりウイルスベクター商用化で絶え間のないイノベーションを実践し、最新の技術とプロセスで迅速に基準を打ち立ててきたパートナーにお任せください。お客様が臨床段階なのか商用化に近づいているのかにかかわらず、メルクには現在と未来の治療を前進させるためのリソース、能力、知識があります。
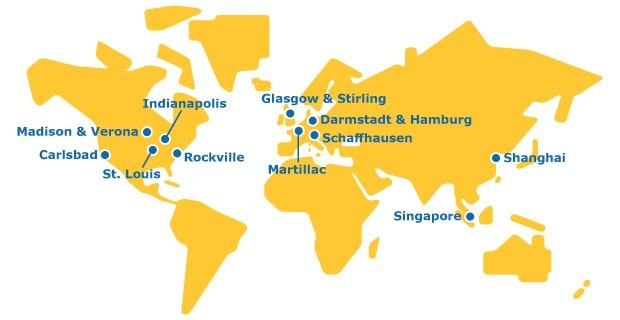
世界に広がるメルクのCTDMO製造拠点
メルクは、グローバルネットワークにより分子バリューチェーンの全段階にわたってCTDMOサービスを提供する、唯一の組織です。
欧州

大規模API製造のための商用化とポートフォリオ脂質API製造施設の世界的ネットワーク拡大のための継続的な投資が、即時開発・製造能力をもたらしています。

私たちのバイオセーフティー試験サービス施設では、セルバンク製造、保管、細胞株特性評価、原薬・製剤のリリース試験サービスを受託しています。

統合されたCTDMOにおいて、カスタムmRNAの開発・製造などを行うmRNA製造拠点です。

25年を超えるGMP経験を有する、mAb製造のためのバイオ医薬品開発・製造施設。パイロット製造プラントやGMP製造プラントの機能を有しています。

API、機能化ポリエチレングリコール(PEG)、脂質の開発・製造・発売施設

私たちの施設には、ウイルスクリアランス試験用の実験室があります。Provise™ウイルスクリアランス試験サービスは、熟練した経験豊富なプロセス担当者と専任の試験責任者で構成されるチームとの連携を通じて、最新鋭の設備を備えたスターリング施設において、ご依頼いただいた全工程をお客様に代わって実施いたします。
アジア

上海施設は、当社の中国バイオ医薬品試験センターに所在し、ウイルスクリアランス試験を提供しています。前臨床開発から国内用と輸出用の製品の商用化段階まで、中国国内でウイルスクリアランス試験の実施が可能です。

CTDMOサービスと連携し、細胞の特性評価、ウイルスクリアランス試験、原薬・製剤のリリース試験を受託している施設です。
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?




