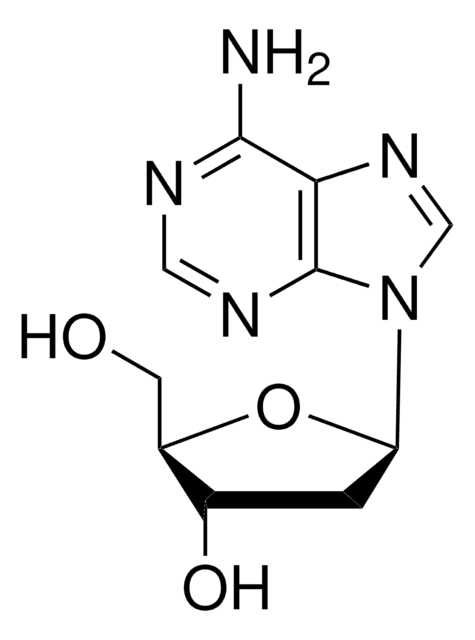
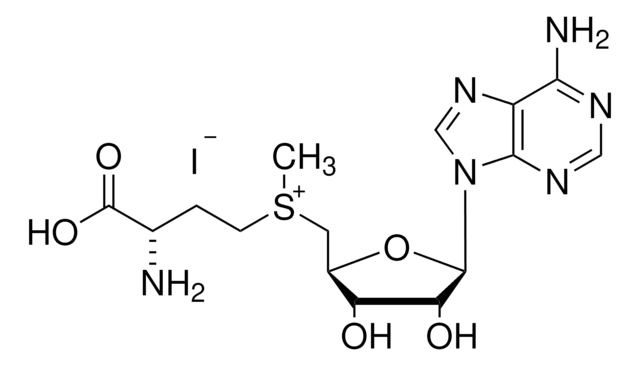
D1771
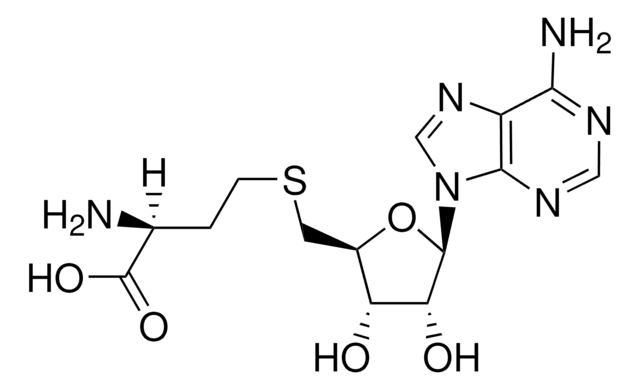
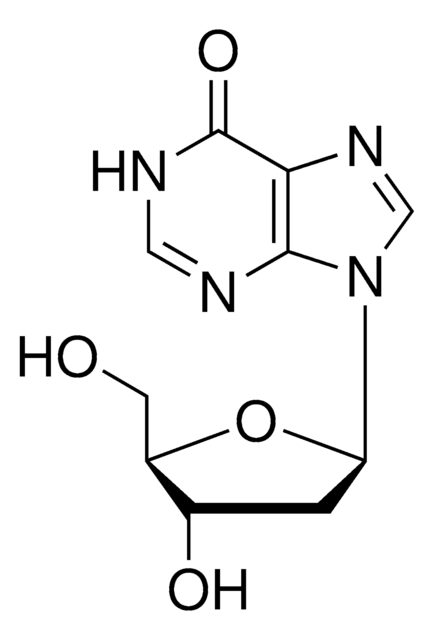
5′-Deoxyadenosine
methylthioadenosine/S-adenosylhomocysteine (MTA/SAH) nucleosidase substrate
Sinonimo/i:
5′-dAdo
About This Item
Prodotti consigliati
Origine biologica
synthetic (organic)
Livello qualitativo
Saggio
≥98% (TLC)
Stato
powder
Solubilità
hot water: 19.60-20.40 mg/mL, clear, colorless
Temperatura di conservazione
2-8°C
Stringa SMILE
C[C@H]1O[C@H]([C@H](O)[C@@H]1O)n2cnc3c(N)ncnc23
InChI
1S/C10H13N5O3/c1-4-6(16)7(17)10(18-4)15-3-14-5-8(11)12-2-13-9(5)15/h2-4,6-7,10,16-17H,1H3,(H2,11,12,13)/t4-,6-,7-,10-/m1/s1
XGYIMTFOTBMPFP-KQYNXXCUSA-N
Cerchi prodotti simili? Visita Guida al confronto tra prodotti
Applicazioni
- as a standard in mass spectroscopy
- as an inhibitor for screening thymidine phosphorylase activity
- as a substrate in 5′-Deoxyadenosine deaminase (DadD) assay
Azioni biochim/fisiol
Codice della classe di stoccaggio
11 - Combustible Solids
Classe di pericolosità dell'acqua (WGK)
WGK 3
Punto d’infiammabilità (°F)
Not applicable
Punto d’infiammabilità (°C)
Not applicable
Dispositivi di protezione individuale
Eyeshields, Gloves, type N95 (US)
Scegli una delle versioni più recenti:
Possiedi già questo prodotto?
I documenti relativi ai prodotti acquistati recentemente sono disponibili nell’Archivio dei documenti.
I clienti hanno visto anche
Il team dei nostri ricercatori vanta grande esperienza in tutte le aree della ricerca quali Life Science, scienza dei materiali, sintesi chimica, cromatografia, discipline analitiche, ecc..
Contatta l'Assistenza Tecnica.