TRYPSEQ-RO
Roche
Grado per il sequenziamento della tripsina
from bovine pancreas
Sinonimo/i:
tripsina
About This Item
Prodotti consigliati
Origine biologica
bovine pancreas
Livello qualitativo
Forma fisica
lyophilized (salt-free)
Attività specifica
≥80 units/mg protein
PM
Mr 23.5 kDa
Confezionamento
pkg of 4 × 100 μg (11047841001)
pkg of 4 × 25 μg (11418475001)
Produttore/marchio commerciale
Roche
pH ottimale
8.0
Temperatura di conservazione
2-8°C
Categorie correlate
Descrizione generale
Specificità
Specificità (HPLC, con insulina Box):
Scissione dopo 1 ora: ≥90%
Prodotti aspecifici della scissione dopo 18 ore: ≤10%
Applicazioni
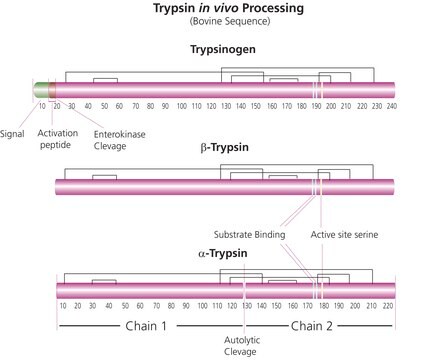
L′enzima è usato per studi di risoluzione della struttura proteica, mappatura triptica, fingerprinting, analisi della sequenza e traslocazione. La tripsina per sequenziamento genera glicopeptidi da glicoproteine purificate ed è adatta alla digestione delle proteine in gel di poliacrilammide.
Qualità
Nota sulla preparazione
Concentrazione di lavoro: da 1/100 a 1/20 della proteina in peso (in soluzione); 1-5 μg/100 μL (per la digestione in gel)
Condizioni di conservazione (soluzione di lavoro): per non più di una settimana, se conservata tra 2 e 8 °C, si può usare una soluzione in 0,01% di acido trifluoroacetico (TFA), (v/v) o 1 mM di HCl. Incubando le proteine in soluzione a un pH neutro o leggermente basico può avere luogo una parziale autolisi. Per questa applicazione Roche raccomanda tripsina, modificata, per sequenziamento.
Ricostituzione
Altre note
Avvertenze
Danger
Indicazioni di pericolo
Consigli di prudenza
Classi di pericolo
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
Organi bersaglio
Respiratory system
Codice della classe di stoccaggio
11 - Combustible Solids
Classe di pericolosità dell'acqua (WGK)
WGK 1
Punto d’infiammabilità (°F)
does not flash
Punto d’infiammabilità (°C)
does not flash
Certificati d'analisi (COA)
Cerca il Certificati d'analisi (COA) digitando il numero di lotto/batch corrispondente. I numeri di lotto o di batch sono stampati sull'etichetta dei prodotti dopo la parola ‘Lotto’ o ‘Batch’.
Possiedi già questo prodotto?
I documenti relativi ai prodotti acquistati recentemente sono disponibili nell’Archivio dei documenti.
I clienti hanno visto anche
Il team dei nostri ricercatori vanta grande esperienza in tutte le aree della ricerca quali Life Science, scienza dei materiali, sintesi chimica, cromatografia, discipline analitiche, ecc..
Contatta l'Assistenza Tecnica.