Fase preclinica

I test condotti in fase preclinica verificano sicurezza ed efficacia del composto candidato prima di avviarlo alla sperimentazione sugli esseri umani, per poter presentare domanda per un nuovo farmaco da sottoporre a sperimentazione clinica (IND) Nello stadio di sviluppo preclinico, occorre prendere in considerazione:
- le caratteristiche dei materiali
- approfonditi test di sicurezza in vitro
- estesi test di sicurezza in vivo
- lo sviluppo del processo
Risorse biotecnologiche
FDA Investigational New Drug (IND) Application
Drug Discovery and Development App
Fasi Upstream del Bioprocessing
Emerging BioTalk
Gene Therapy and Viral Vaccine Contract Manufacturing
Volantino: ADC Express™
Biopharmaceutical Application Guide
Brochure: Integrated Bioprocess Solutions
I servizi di studi tossicologici rivestono un’importanza cruciale. Occorre infatti far ricorso a un ampio spettro di test tossicologici in vitro ed in vivo, da inquadrare in un disegno sperimentale che rispetti le linee guida internazionali e sia poi condotto in piena conformità con la regolamentazione delle buone pratiche di laboratorio (GLP)
Criticità nello sviluppo del processo
- Sviluppo di linee cellulari
- Selezione del clone
- Screening dei terreni e dei nutrienti
- Sviluppo delle fasi upstream del processo
- Realizzazione di master cell bank
- Sviluppo delle fasi downstream del processo
- Sviluppo della formulazione
- Sviluppo e ottimizzazione dei metodi analitici
- Assistenza allo sviluppo delle procedure analitiche
- Programmi analitici di confronto tra biosimilari
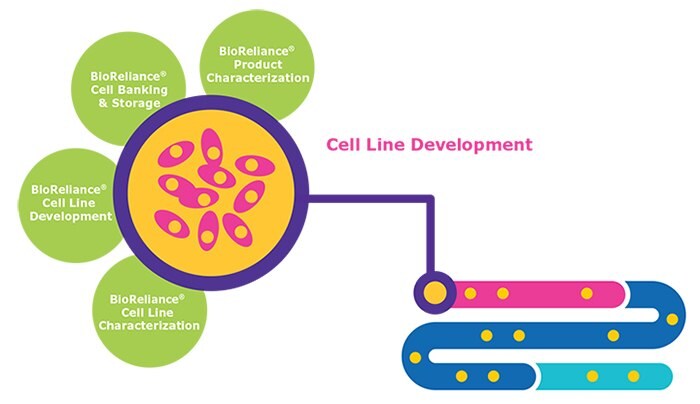
Criticità nello sviluppo di linee cellulari
- Scelta del clone – è essenziale disporre di linee che possano produrre il principio biologico a livelli di concentrazione e di qualità sufficientemente elevati
- Studi di robustezza – occorrono metodologie consolidate per condurre studi che riproducano le condizioni di scale-up del processo
- Stabilità genetica – la produzione e la qualità della proteina devono rimanere stabili anche dopo un numero di generazioni cellulari >60
Criticità nello sviluppo del processo
- Efficienza del processo – occorre eliminare i passaggi superflui e ottimizzare l’utilizzo della capacità produttiva delle aree polifunzionali.
- Fattibilità del processo – è necessario che il processo sia replicabile a livello di scale-up e trasferibile alle operazioni successive
- Fattibilità finanziaria – occorre bilanciare la produttività e o costi connessi per definire una complessiva fattibilità finanziaria

Criticità tecnologiche
- La flessibilità può ridurre il costo dei beni – l’impiego di attrezzature monouso incrementa la flessibilità, la possibilità di ricorrere a modelli predefiniti, la rapida configurazione delle linee e riduce i costi di lavaggio
- La scalabilità è un fattore chiave – nella scelta delle tecnologie nello stadio iniziale del percorso, come nel caso dello scale-up di un bioreattore per colture di cellule di mammifero da 3 L a 200 L e poi a 2000 L
- Valutare la facilità d’uso – ricorrendo a soluzioni come linee di flusso preassemblate per processi sterili e interfacce che consentano connessioni, disconnessioni e riconnessioni sterili
Criticità normative
- Sicurezza del paziente – è prioritario che ad ogni passo in avanti dello sviluppo clinico siano verificate la sicurezza e l’efficacia del prodotto
- Qualità del prodotto e robustezza del processo – la raccolta e l’analisi dei dati devono aver luogo in parallelo con lo sviluppo del processo
- Dialogo con le autorità normative – la conoscenza dei paesi in cui si intende registrare il farmaco è un riferimento essenziale per chi ispeziona gli impianti produttivi
Criticità in fase di commercializzazione
- Velocità di ingresso sul mercato – in ricerca e sviluppo gli investimenti senza ritorno sono di entità riguardevole
- Efficienza del processo – è necessario tenere in debito conto per tempo non solo la velocità del processo nelle prime fasi di sviluppo, ma anche i passaggi di scala che seguiranno
- Strategia di approvazione – essenziale per stabilire in quale paese presentare richiesta per primo e per guadagnare in fretta l’accesso al mercato
Le giuste risorse vi permettono di concentrare gli sforzi nello sviluppo di nuove soluzioni, che potranno aiutare i pazienti più bisognosi. Per saperne di più, cominciate esplorando una qualsiasi delle fasi del processo di sviluppo. Oppure seguite i link ai prodotti e ai servizi: troverete risorse supplementari che sono altrettante opportunità plug-and-play specifiche per le fasi di avvio della vostra nuova impresa.
Centro delle risorse biotech: il percorso a tappe


Discovery
Identificare gli studi, le risorse e il sostegno che vi occorrono per sviluppare un nuovo candidato biologico.

Fasi I e II
Accelerare il vostro processo di sviluppo con suggerimenti, modelli e guide applicative

Fase III e produzione
Passare dallo scale-up e dal trasferimento di tecnologie alla produzione di qualità per i trial clinici e la commercializzazione

Programmi per startup
Attivare risorse e programmi di sostegno in grado di valorizzare il potenziale della vostra molecola

Conformità legislativa
Destreggiarsi in un settore industriale tra i più regolamentati al mondo con una guida di fiducia al vostro fianco
Per continuare a leggere, autenticati o crea un account.
Non hai un Account?