Production de vaccins à vecteur viral
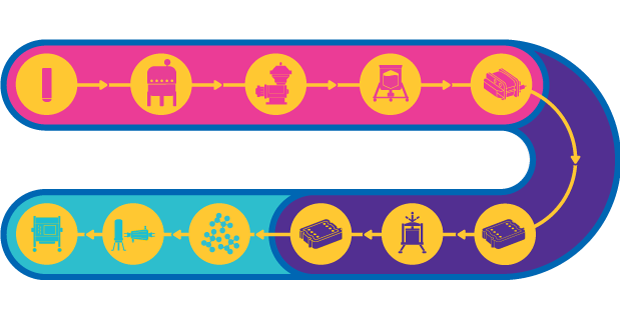
Fig 1.Étapes du processus de production d'un vaccin à vecteur viral
Un vaccin à vecteur vivant utilise un micro-organisme atténué ou inoffensif (adénovirus par exemple) pour transporter des morceaux d'antigène et stimuler une réponse immunitaire. Les vaccins basés sur un vecteur sont capables d'induire une immunité cellulaire puissante, qui est cruciale pour les maladies comme le SIDA, le paludisme ou le cancer, pour n'en citer que quelques-unes.
Même si le procédé de production des vecteurs pour vaccin est relativement standardisé, certaines difficultés peuvent survenir du fait de l'utilisation de plusieurs virus différents aux propriétés variées. Pour les vecteurs viraux de grande taille, la stérilité du procédé est un point critique, du fait de la perte de rendement liée à la filtration stérilisante. Il peut aussi y avoir des problèmes d'agrégation et de stabilité des vecteurs.
De plus, nombre de procédés de phase I/II font intervenir des cultures de cellules adhérentes ; de ce fait, la transposition d'échelle pour la phase III et la fabrication à l'échelle commerciale peuvent nécessiter des ajustements opérationnels pour atteindre les objectifs de production. Pour les dernières étapes du procédé de fabrication, le rendement et la pureté du produit ont un rôle déterminant, car le produit final doit avoir un titre élevé.
Ressources apparentées
Bioproduction
Biopharmaceutical Applications Guide - Vaccines
Brochure : Vaccine Bioprocessing Handbook
Mini-guide : Viral Vector Vaccine Bioprocessing
Webinaire : Process Development Guidance for AAV and Lentivirus Manufacturing Based on Cost Modeling
Webinaire : Sf-RVN Cell Line & CD Media Platform, A Production Platform for VLP and AAV
Livre blanc : Developing an Accelerated and More Cost-Effective Single-Use Adenoviral Vector Vaccine Manufacturing Process
Réduction de l'ADN
Purification et clarification
Article technique : Purification or Removal of Viruses including Adeno-Associated Virus
Article : Robust Harvest Clarification For Adeno-Associated Viral Vectors Via Depth Filtration
Article : Clarification of vaccines: An Overview of Filter-Based Technology Trends and Best Practices
Article : Filter-Based Clarification of Viral Vaccines and Vectors Biosafety
Article : How to Ensure Biosafety Of Novel Viral Therapies
Accélérer le passage à la phase clinique tout en garantissant une transposition d'échelle fiable
Les procédés de culture upstream mis au point pour la fabrication des vaccins à vecteur viral doivent être optimisés de façon à respecter les objectifs de productivité. Cette optimisation inclut les étapes de lyse cellulaire et de clarification qui sont cruciales pour le retrait des cellules et des débris cellulaires et pour garantir une récolte robuste des vecteurs. Le procédé upstream n'est toutefois concluant que s'il peut être transposé de manière fiable et de façon à répondre aux prévisions de la demande du marché.
Atteindre les objectifs de rendement et d'efficacité avec une élimination robuste des impuretés
Les acides nucléiques provenant des cellules lysées sont un contaminant courant des procédés de production de vaccin à vecteur viral. Les réglementations imposent un niveau de contamination par les acides nucléiques issus des cellules hôtes inférieur à 10 ng/dose de vaccin viral atténué. L'association d'un traitement à l'endonucléase Benzonase® puis d'une filtration à flux tangentiel est un moyen puissant et robuste de dégrader et d'éliminer les fragments d'acides nucléiques résiduels.
Maximiser la quantité de produit récupéré en aval
Les petits lots cliniques sont typiquement purifiés par ultracentrifugation à gradient de densité avec CsCl, tandis que la production à grande échelle requiert un procédé chromatographique en deux ou trois étapes. L'échange d'anions est généralement employé pour retirer les HCP, l'ADN, l'ARN et les autres contaminants majeurs. La chromatographie d'exclusion stérique sert quant à elle à éliminer les contaminants à l'état de traces.
Garantir la sécurité des patients
La filtration stérilisante permet d'assurer la stérilité du produit formulé final et la sécurité des patients. Pour éliminer les contaminants microbiens, il est nécessaire d'utiliser un filtre avec une dimension de pores de 0,22 µm ou moins. Un élément essentiel dont il faut tenir compte pour le procédé de filtration stérilisante est le taux d'agrégats viraux. Ces agrégats doivent être limités en optimisant la formulation ; dans le cas contraire, le procédé de filtration stérilisante sera difficile et risque de provoquer une forte chute de rendement.
Traitement avec des nucléases et clarification
Obtenez une transposition d'échelle robuste.
- • Nuclease treatment with Benzonase® suitable for biopharmaceutical production EMPROVE® bio
- • Benzonase® Detection with Benzonase® Elisa Kit II to detect left over Benzonase® endonuclease in the process
- • Primary/Secondary Clarification with Millistak+® HC POD Depth Filters
- • Primary Clarification with Clarisolve® Depth Filters
- • Clarification Depth Filters & Pretreatment Solutions

Filtration à flux tangentiel downstream
Atteignez vos objectifs de rendement, d'efficacité et de quantité d'ADNp récupéré tout en garantissant une élimination robuste des impuretés.
Chromatographie downstream
- • Membrane Chromatography with Natrix® Q Pilot Chromatography Membranes
- • Membrane Chromatography with Natrix® Q Recon Mini
- • Membrane Chromatography with Eshmuno® Q Resin
- • Affinity Chromatography with Fractogel® EMD DEAE Chromatography Resins
- • Affinity Chromatography with Fractogel® EMD DMAE Chromatography Resins

Formulation et produits chimiques pour les procédés downstream

Tampons et milieux de culture cellulaire liquides pour la bioproduction
Nous proposons la meilleure qualité de liquides stérilisés par filtration du marché : nos produits de NEP et de SEP, nos tampons et nos milieux de culture cellulaire prêts à l'emploi proviennent de sites conformes aux BPF répartis dans le monde entier et vous permettent d'optimiser votre production biopharmaceutique.
Filtration stérilisante finale et remplissage final
Garantissez la sécurité des patients avec un procédé de filtration stérilisante fiable et robuste.
· Filtration stérilisante finale et remplissage final
· Stratégies de filtration stérilisante
· Prélèvement stérile avec les solutions d'échantillonnage stérile NovaSeptum® Go
· Remplissage-finition avec les solutions de remplissage-finition à usage unique Mobius®

Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?



