Production de vaccins à base de virus
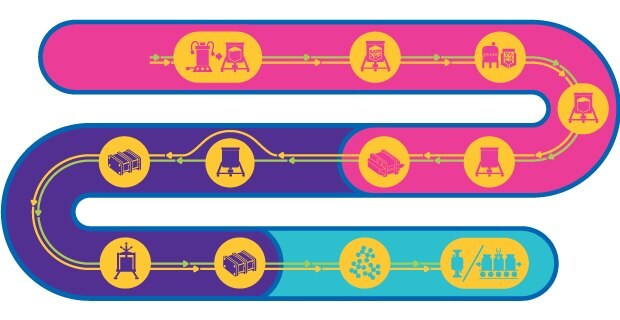
Étapes du processus de production d'un virus inactivé et d'un virus atténué vivant
Les vaccins à base de virus contiennent soit des virus atténués, soit des virus inactivés. Ces vaccins ont la capacité d'activer toutes les phases de la réponse immunitaire et confèrent une immunité durable et rapide à long terme en déclenchant la production d'anticorps neutralisants dirigés contre le pathogène cible.
Le procédé de fabrication de vaccins à base de virus atténués est complexe, se compose de plusieurs étapes et doit conserver le potentiel infectieux du virus atténué. Même s'il existe un schéma général pour la production de ce type de vaccin, il n'y a aucune approche standardisée. Chaque procédé doit donc être adapté en fonction de la forme, de la taille, de la nature, du comportement physicochimique, de la stabilité et de la spécificité en termes d'hôte du virus.
Ressources apparentées
Biopharmaceutical Applications Guide
Brochure : Vaccine Bioprocessing Handbook
Mini-guide : Cell-Based Vaccine Bioprocessing
Brochure : Enabling Solutions for Vaccines and Viral Therapies
Livre blanc : Filtration Strategies for Optimal Development and Purification of a Foot and Mouth Disease Virus
Livre blanc : Downstream Process Intensification for Virus Purification Using Membrane Chromatography
Note d'application : Effect of Benzonase® Endonuclease Addition to Purification of Sabin Polio Virus Type 3
Article technique : Choosing the Optimal Cell Culture Media for Vaccine Production
Article technique : Choosing the Optimal Vaccine Adjuvant
Article : Nucleic Acid Impurity Reduction in Viral Vaccine Manufacturing
Article : Filter-Based Clarification of Viral Vaccines and Vectors
Optimiser la productivité et la clarification upstream avec une transposition d'échelle fiable
Les procédés de culture upstream développés pour la fabrication des vaccins à base de virus doivent être optimisés de façon à respecter les objectifs de productivité. Cette optimisation inclut l'étape de clarification qui est cruciale pour le retrait des cellules et des débris cellulaires et pour garantir une récolte robuste des virus. Le procédé upstream n'est toutefois concluant que s'il peut être transposé de manière fiable et de façon à répondre aux prévisions de la demande du marché.
Atteindre les objectifs de rendement et d'efficacité avec une élimination robuste des impuretés
Les acides nucléiques provenant des cellules lysées sont un contaminant courant des procédés de production de vaccin à base de virus. Les réglementations imposent un niveau de contamination par les acides nucléiques issus des cellules hôtes inférieur à 10 ng/dose de vaccin à base de virus atténué. L'association d'un traitement à l'endonucléase Benzonase® puis d'une filtration tangentielle est un moyen puissant et robuste de dégrader et d'éliminer les fragments d'acides nucléiques résiduels.
Maximiser la quantité de produit récupéré en aval
Un traitement à l'endonucléase Benzonase® suffit, pour la plupart des vaccins à base de virus, à atteindre le niveau de pureté recherché durant la concentration et la diafiltration. Une chromatographie est toutefois nécessaire pour atteindre le niveau de pureté requis pour les vaccins à base de virus de prochaine génération tels que ceux destinés au virus de l'encéphalite japonaise (VEJ) et au virus de la dengue (DENV). Puisque chaque procédé de fabrication doit être adapté aux caractéristiques du virus utilisé, il est crucial, pour atteindre la pureté recherchée tout en garantissant une quantité de produit récupéré optimale, de disposer d'une boîte à outils regroupant les différentes options de purification downstream.
Garantir la sécurité des patients
Même si les vaccins à base de virus sont fabriqués à l'aide de virus atténués, assurer la sécurité des patients demeure une préoccupation importante. Le vaccin viral final en vrac ressemble à de l'eau. Il peut donc être stérilisé par filtration stérilisante sur un filtre de 0,22 µm avant les étapes de formulation finale et de remplissage final.
Processus
Traitement avec des nucléases et clarification
Obtenez une transposition d'échelle robuste
- Nuclease treatment with Benzonase® suitable for biopharmaceutical production EMPROVE® bio
- Benzonase® Detection with Benzonase® Elisa Kit II to detect left over Benzonase® endonuclease in the process
- Primary/Secondary Clarification with Millistak+® HC POD Depth Filters
- Primary Clarification with Clarisolve® Depth Filters
- Secondary Clarification with Polysep II cartridges

Tampons et milieux de culture cellulaire liquides pour la bioproduction
Nous proposons la meilleure qualité de liquides stérilisés par filtration du marchés : nos produits de NEP et de SEP, nos tampons et nos milieux de culture cellulaire prêts à l'emploi proviennent de sites conformes aux BPF répartis dans le monde entier et vous permettent d'optimiser votre production biopharmaceutique.

Filtration tangentielle downstream
Atteignez vos objectifs de rendement, d'efficacité et de quantité de virus récupéré tout en garantissant une élimination robuste des impuretés
Chromatographie downstream
- Membrane Chromatography with Eshmuno® Q Resin
- Membrane Chromatography with Natrix® Q Recon Mini Chromatography Membranes
- Membrane Chromatography with Natrix® Q Pilot Chromatography Membrane
- Capture an/or Polishing Chromatography with Fractogel® EMD DEAE Chromatography Resins
- Capture an/or Polishing Chromatography with Fractogel® EMD DMAE Chromatography Resins

Produits chimiques industriels et formulation
Filtration stérilisante finale et remplissage final
Débarrassez-vous des problèmes de contamination croisée des produits tout en rationalisant les exigences du remplissage et de la finition et en vous conformant aux dispositions réglementaires en vigueur

Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?


