Wichtige Dokumente
T1426
Trypsin aus Rinderpankreas
TPCK Treated, essentially salt-free, lyophilized powder, ≥10,000 BAEE units/mg protein
Synonym(e):
Serine Protease 1
About This Item
Empfohlene Produkte
Biologische Quelle
bovine pancreas
Qualitätsniveau
Qualität
Proteomics Grade
Form
essentially salt-free, lyophilized powder
Spezifische Aktivität
≥10,000 BAEE units/mg protein
Mol-Gew.
23.8 kDa
Löslichkeit
hydrochloric acid: soluble 1 mM
Anwendung(en)
diagnostic assay manufacturing
Fremdaktivität
Chymotrypsin ≤0.1 BTEE units/mg protein
Lagertemp.
−20°C
Suchen Sie nach ähnlichen Produkten? Aufrufen Leitfaden zum Produktvergleich
Anwendung
Biochem./physiol. Wirkung
Serinprotease-Inhibitoren, u. a. DFP, TLCK, APMSF, AEBSEF und Aprotinin, hemmen Trypsin.
Komponenten
Vorsicht
Einheitendefinition
Angaben zur Herstellung
TPCK-behandelt und dialysiert. Die Behandlung mit L-1-Tosylamid-2-phenylethylchlormethylketon (TPCK) reduziert die Chymotrypsinaktivität, die normalerweise bei Trypsin vorhanden ist.
Inhibitor
Substrat
Signalwort
Danger
H-Sätze
Gefahreneinstufungen
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
Zielorgane
Respiratory system
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 1
Persönliche Schutzausrüstung
dust mask type N95 (US), Eyeshields, Faceshields, Gloves
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Protokolle
This procedure is for products with a specification for Trypsin activity using Na-Benzoyl-L-arginine ethyl ester (BAEE) as a substrate. The procedure is a continuous spectrophotometric rate determination (A253, Light path = 1 cm).
Verwandter Inhalt
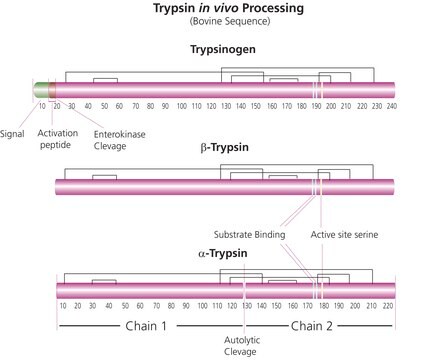
Trypsin is an enzyme in the serine protease class that consists of a polypeptide chain of 223 amino acid residues. Multiple sources, grades and formulations of trypsin specifically designed for research applications are available.
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.