A1153
Aprotinin
3-8 TIU/mg solid, lyophilized powder
Synonym(e):
BPTI, Boviner pankreatischer Trypsin-Inhibitor, Trasylol, Trypsin-Inhibitor (basisch, pankreatisch)
About This Item
Empfohlene Produkte
product name
Aprotinin aus Rinderlunge, lyophilized powder, 3-8 TIU/mg solid
Biologische Quelle
bovine lung
Qualitätsniveau
Form
lyophilized powder
Spezifische Aktivität
3-8 TIU/mg solid
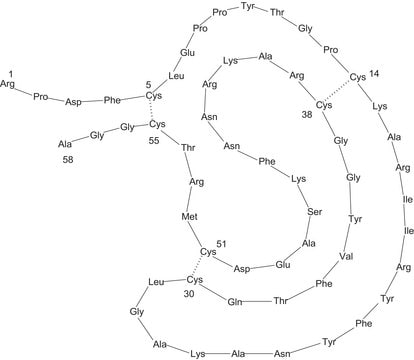
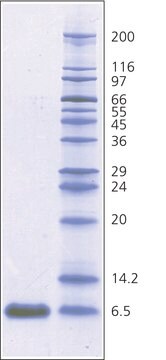
Mol-Gew.
~6,500
Löslichkeit
H2O: ≥5 mg/mL
UniProt-Hinterlegungsnummer
Lagertemp.
2-8°C
InChIKey
ZPNFWUPYTFPOJU-UHFFFAOYSA-N
Angaben zum Gen
cow ... PTI(404172)
Suchen Sie nach ähnlichen Produkten? Aufrufen Leitfaden zum Produktvergleich
Allgemeine Beschreibung
Anwendung
- als Proteasehemmer in Radioimmunpräzipitationspuffer (RIPA) zur Homogenisierung von kardialen mikrovaskulären Endothelialzellen (CMECs)(4) und humanen Brustepithelzellen
- in Angiogenese-Assays von Fibroblasten
- bei der proteomischen Stabilisierung von Speichelüberstand
Biochem./physiol. Wirkung
Einheitendefinition
Angaben zur Herstellung
auch häufig zusammen mit diesem Produkt gekauft
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 1
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Persönliche Schutzausrüstung
Eyeshields, Gloves, type N95 (US)
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Artikel
While aprotinin and bovine pancreatic trypsin inhibitor (BPTI) are the same protein sequence, the term aprotinin is typically used when describing the protein derived from bovine lung.
Enzyme Explorer Product Application Index for Elastase. Leukocyte elastase is a 29KDa serine endoprotease of the Proteinase S1 Family. It exists as a single 238 amino acid-peptide chain with four disulfide bonds.
Analytical Enzyme Chymotrypsin: Chymotrypsin is produced in the acinar cells of the pancreas as the inactive precursor, chymotrypsinogen.
Protokolle
Objective: To standardize a procedure for the enzymatic assay of Aprotinin.
Verwandter Inhalt
Trypsin is an enzyme in the serine protease class that consists of a polypeptide chain of 223 amino acid residues. Multiple sources, grades and formulations of trypsin specifically designed for research applications are available.
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.