Sintesi peptidica
Un peptide è costituito da due o più amminoacidi legati tra loro da un legame ammidico a formare una catena composta di norma da 2 – 70 amminoacidi. I peptidi si distinguono dalle proteine perché non hanno bisogno di essere ripiegati per svolgere la loro attività biologica. Sono peptidi endogeni alcuni ormoni come l’angiotensina, LHRH e l’encefalina; anche diverse tossine animali e vegetali sono costituite da peptidi. I peptidi rivestono grande interesse come lead per il drug discovery e come farmaci essi stessi. Trovano inoltre applicazione nei vaccini, nei biomateriali e nelle sonde molecolari (p.es. per applicazioni istologiche), e vengono ampiamente utilizzati come antigeni per generare anticorpi.
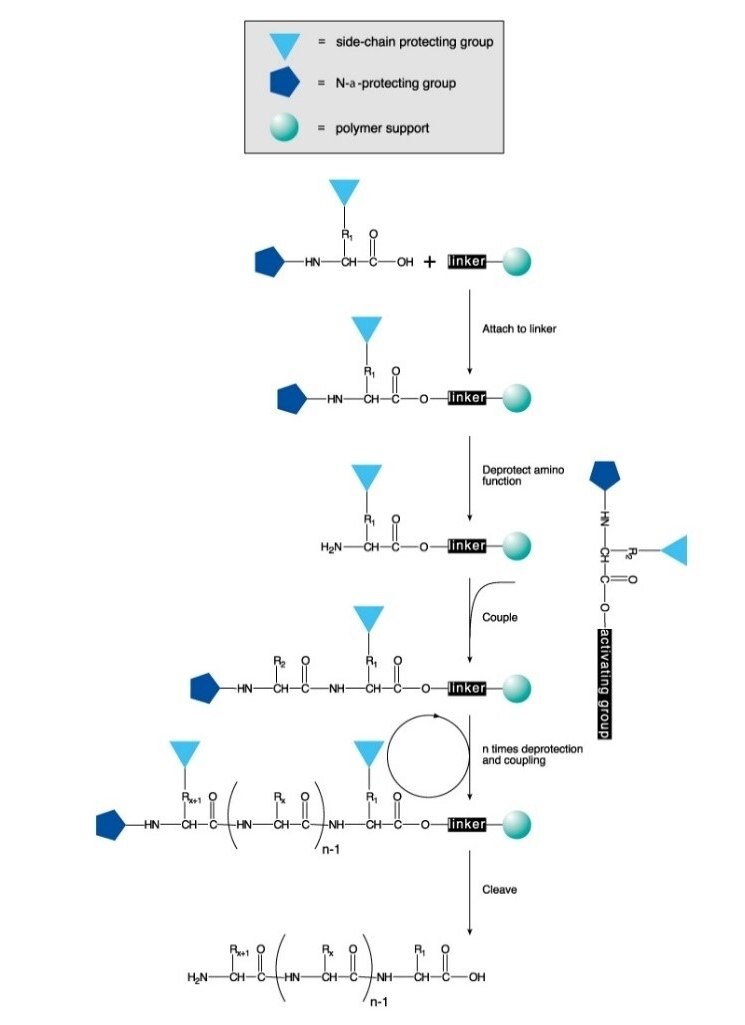
I peptidi vengono preparati per sintesi chimica in soluzione o in fase solida. Il processo consiste nella formazione controllata e selettiva di un legame ammidico fra un amminoacido N-protetto e un amminoacido che presenta il gruppo amminico libero e la funzione carbossilica protetta. Nella sintesi in fase solida, il gruppo di protezione del carbossile è legato ad un supporto polimerico. Dopo la formazione del legame, il gruppo che protegge il gruppo amminico del dipeptide viene rimosso e si procede con l'accoppiamento del successivo amminoacido N-protetto.
Articoli tecnici correlati
- Fmoc resin cleavage and deprotection follows the difficult task of detaching the peptide from the resin support and removing all the side-chain protecting groups of the amino acid residues to yield the desired peptide.
- Novabiochem® offers a large number of coupling reagents for in situ activation. In situ activating reagents are easy to use, fast reacting – even with sterically hindered amino acids, and their use is generally free of side reactions.
- Review methods and resins for attaching amino acids and peptides, including Merrifield, trityl-based, and hydroxymethyl-functionalized resins. Resin-immobilized peptides can be used for various downstream applications.
- COMU is a non-explosive coupling agent suitable for solution phase & solid phase peptide synthesis. Its activity meets or exceeds that of HATU and its water-soluble by-product are easily removed.
- In principle, the seemingly simple formation of a peptide bond can be accomplished using all the procedures available in organic chemistry for the synthesis of carboxylic acid amides. However, due to the presence of various functional groups in natural and unnatural amino acids and particularly the requirement for full retention of chiral integrity, the coupling of amino acids and peptides under mild conditions can be challenging. A plethora of coupling reagents has been developed superseding each other in efficiency and suitability for specific applications (e.g., solid-phase peptide synthesis or fragment condensation).
- Visualizza tutti (22)
Protocolli correlati
- A guide to create solvent systems used for the thin-layer chromatography assay of Novabiochem products.
- Overcome challenges in synthesis and disulfide bond formation with protocols for Fmoc solid-phase peptide synthesis of peptides with cysteine and methionine.
- Amide Coupling in a Box
- Information on the Amide bond and the Catalytic Amide Bond Formation Protocol. Amidation of amines and alcohols. The amide bond, an important linkage in organic chemistry, is a key functional group in peptides, polymers, and many natural products and pharmaceuticals.
- We provide an overview of our available reagents, together with recommendations and details of their use for synthesis of peptides containing post-translationally modified amino acids.
- Visualizza tutti (10)

Figura 2.Gruppi di protezione delle catene laterali per la sintesi di peptidi Boc-protetti in fase solida (SPPS)
La sintesi peptidica in fase solida (SPPS) è il metodo usato più di frequente per la sintesi peptidica, grazie alla sua efficienza, alla sua semplicità, alla sua velocità ed alla facilità con cui è possibile condurla in parallelo. La SPPS consiste nell’aggiunta in sequenza di residui amminoacidici con il gruppo amminico e le catene laterali protette a un amminoacido o a un peptide attaccato ad un supporto polimerico insolubile (Figura 1).
Per la protezione dell’azoto N-α si ricorre a un gruppo tert-butilossicarbonile (Boc) sensibile agli acidi (Boc SPPS) o a un gruppo Fmoc sensibile alle basi (Fmoc SPPS). Dopo la rimozione di questo gruppo protettivo, si procede all'aggiunta del successivo amminoacido protetto utilizzando o un reagente di accoppiamento o un amminoacido protetto e pre-attivato. L’amminoacido C-terminale è ancorato alla resina attraverso un linker, la cui natura determina le condizioni necessarie per rilasciare il peptide dal supporto dopo l’estensione della catena. I gruppi di protezione delle catene laterali sono spesso scelti in modo che si stacchino contestualmente al distacco del peptide dalla resina(Figure 2 e 3).

Figura 3.Gruppi di protezione delle catene laterali per la sintesi di peptidi Fmoc-protetti in fase solida (SPPS)
La maggior parte dei peptidi viene preparata con il metodo Fmoc perché il distacco finale e la deprotezione sono condotte mediante trattamento con acido trifluoroacetico, contrariamente al metodo Boc che necessita di HF anidro liquido, altamente tossico e corrosivo, e di attrezzatura specializzata.
Di routine è possibile preparare peptidi di 50 amminoacidi, ma sono note in letteratura assai comunemente sintesi di proteine con oltre 100 amminoacidi. Proteine più lunghe possono essere ottenute mediante ligazione chimica in ambiente nativo di peptidi completamente deprotetti in soluzione. Con questo metodo è possibile: sintetizzare peptidi naturali che sono difficili da esprimere in batteri, incorporare D-aminoacidi o amminoacidi artificiali e originare peptidi ciclici, ramificati, marcati o post-translazionalmente modificati.
La sintesi peptidica in fase liquida, condotta di solito facendo ricorso alla protezione con gruppi Boc o benzilossicarbossile (Z), è stata soppiantata dalla sintesi in fase solida, con l’eccezione dei processi di sintesi su larga scala di peptidi per finalità industriali.
Per continuare a leggere, autenticati o crea un account.
Non hai un Account?