Alle Fotos(1)
Wichtige Dokumente
T7915
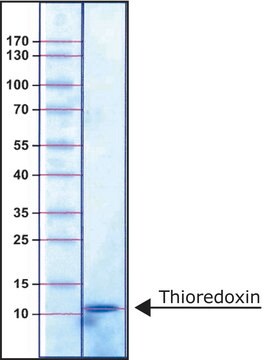
Thioredoxin-Reduktase aus E. coli
ammonium sulfate suspension, >25 units/mg protein (Bradford)
Synonym(e):
NADPH:oxidierte Thioredoxin-Oxidoreduktase
Anmeldenzur Ansicht organisationsspezifischer und vertraglich vereinbarter Preise
Alle Fotos(1)
About This Item
CAS-Nummer:
MDL-Nummer:
UNSPSC-Code:
12352204
NACRES:
NA.32
Empfohlene Produkte
Biologische Quelle
Escherichia coli
Qualitätsniveau
Form
ammonium sulfate suspension
Spezifische Aktivität
>25 units/mg protein (Bradford)
Mol-Gew.
70 kDa
Methode(n)
activity assay: suitable
UniProt-Hinterlegungsnummer
Lagertemp.
2-8°C
Angaben zum Gen
Escherichia coli K12 ... trxB(949054)
Allgemeine Beschreibung
Forschungsbereich: Zellsignalgebung
Thioredoxinreduktasen (TrxR) gehören zur Familie der seleniumhaltigen Pyridin-Nukleotid-Disulfid-Oxidoreduktasen.
Thioredoxinreduktasen (TrxR) gehören zur Familie der seleniumhaltigen Pyridin-Nukleotid-Disulfid-Oxidoreduktasen.
Anwendung
Thioredoxin-Reduktase aus Escherichia coli wird in Assays zum Untersuchen der Thioredoxin-Reduktase-Aktivität und in Peroxiredoxin-Assays verwendet.
Darüber hinaus wird es zum Untersuchen des Synergieeffekts zwischen Brokkolisprossenextrakt und Selen bei der Hochregulierung von Thioredoxin-Reduktase in menschlichen Hepatozyten eingesetzt.
Darüber hinaus wird es zum Untersuchen des Synergieeffekts zwischen Brokkolisprossenextrakt und Selen bei der Hochregulierung von Thioredoxin-Reduktase in menschlichen Hepatozyten eingesetzt.
Thioredoxinreduktase aus Escherichia coli kann in einem peroxidasegekoppelten Thioredoxin-System-Assay zur Beurteilung der Peroxidase-Aktivität von Cys-basierten Thiol-Peroxidasen verwendet werden. Thioredoxinreduktase aus Escherichia coli wird wie folgt verwendet:
- zur Bestimmung der Enzymaktivität von His6-Ahp1p
- zur Bestimmung von TRXR in C. elegans mittels TXN-abhängigem Aktivitätsassay
- zur Untersuchung der biologischen Reduktionssysteme für das gegen organisches Hydroperoxid resistente R-Gen (OhrR)
- beim enzymatischen Targeting von Auranofin, um dessen antimikrobiellen Eigenschaften zu testen
- bei der Thioredoxinreduktase-Aktivität und beim Peroxiredoxin-Test
- zur Untersuchung der Synergie zwischen Brokkolisprossenextrakt und Selen bei der Hochregulierung von Thioredoxinreduktase in humanen Hepatozyten
Biochem./physiol. Wirkung
Ein FAD-haltiges Enzym, das am Wasserstofftransfer aus E. coli-Thioredoxin in andere Proteine beteiligt ist, sodass ein leistungsstarkes Disulfid-Reduktase-System entsteht.
Thioredoxin-Reduktase ist ein FAD-haltiges Enzym, das mithilfe des FAD-Anteils innerhalb der Cys-Ala-Thr-Cys-Sequenz das Reduktionsäquivalent aus NADPH in die Disulfidbindung des Enzyms überträgt. Zudem kann es mittels NADPH Trx-S2 zu Trx-(SH)2 reduzieren.
Thioredoxin-Reduktase (TrxR) ist eine NADPH-abhängige Oxidoreduktase mit einem FAD pro Untereinheit, die das Disulfid auf der aktiven Seite zu oxidiertem Thioredoxin (Trx) reduziert. Das Molekulargewicht der Isozyme aus Säugetieren variiert zwischen 55 und 67 kDa im Vergleich zu 35 kDa bei Prokaryoten, Pflanzen oder Hefe. Die Substratspezifität des Säugerenzyms ist deutlich breiter als die des Prokaryotenenzyms, wodurch die Reduktion von Säuger- und E. coli-Thioredoxinen sowie von Disulfid-freien Substraten wie Selenit, Lipoinsäuren, Lipidhydroperoxiden und Wasserstoffperoxid ermöglicht wird.
Einheitendefinition
Eine Einheit führt zu einem Extinktionsanstieg von 1,0 bei 412 nm (bei Messung in einem gekoppelten Assay mit E. coli-Thioredoxin und DTNB) pro Minute und Milliliter bei einem pH-Wert von 7,0 und 25 °C.
Physikalische Form
Suspension in 3,6 M (NH4)2SO4 mit 30 mM Kaliumphosphatpuffer und 2 mM EDTA, pH-Wert 7,5.
Lagerklassenschlüssel
12 - Non Combustible Liquids
WGK
WGK 1
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Hier finden Sie alle aktuellen Versionen:
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Thioredoxin and thioredoxin reductase.
A Holmgren et al.
Methods in enzymology, 252, 199-208 (1995-01-01)
Functional characterization of Clostridium difficile spore coat proteins
Permpoonpattana P, et al.
Journal of Bacteriology, JB-02104 (2013)
Purification and characterization of ferredoxin-NAD (P)+ reductase from the green sulfur bacterium Chlorobium tepidum
Seo D, et al.
Biochim. Biophys. Acta Gen. Subj., 1597(1), 123-132 (2002)
Valérie Prouzet-Mauléon et al.
The Journal of biological chemistry, 277(7), 4823-4830 (2001-11-24)
Yeasts lacking cytoplasmic superoxide dismutase (Cu,Zn-SOD) activity are permanently subjected to oxidative stress. We used two-dimensional PAGE to examine the proteome pattern of Saccharomyces cerevisiae strains lacking Cu,Zn-SOD. We found a new stable form of alkyl hydroperoxide reductase 1 (Ahp1)
Synergy between broccoli sprout extract and selenium in the upregulation of thioredoxin reductase in human hepatocytes
Li D, et al.
Food Chemistry, 110(1), 193-198 (2008)
Artikel
Instructions for working with enzymes supplied as ammonium sulfate suspensions
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.