06880
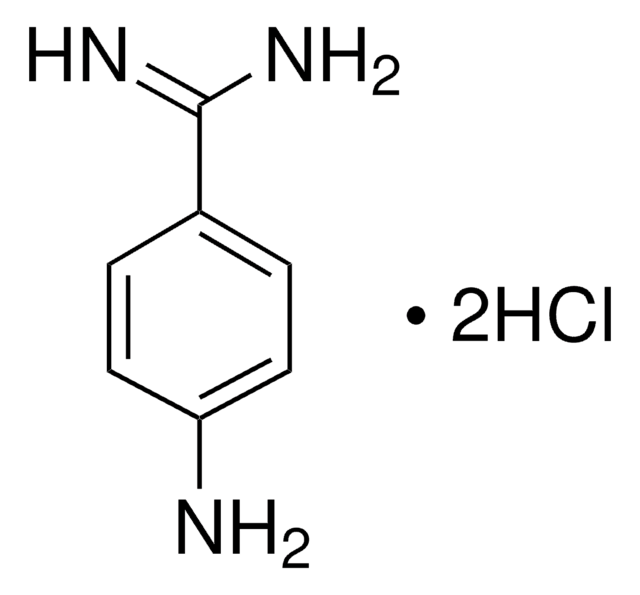
4-Aminobenzamidine dihydrochloride
BioReagent, suitable for fluorescence, ≥99.0% (TLC)
Faça loginpara ver os preços organizacionais e de contrato
About This Item
Fórmula linear:
H2NC6H4C(=NH)NH2·2HCl
Número CAS:
Peso molecular:
208.09
Beilstein:
3692927
Número CE:
Número MDL:
Código UNSPSC:
12352100
ID de substância PubChem:
NACRES:
NA.32
Produtos recomendados
linha de produto
BioReagent
Ensaio
≥99.0% (TLC)
Formulário
powder or crystals
pf
>300 °C (lit.)
fluorescência
λex >300 nm in H2O
adequação
suitable for fluorescence
temperatura de armazenamento
2-8°C
cadeia de caracteres SMILES
Cl[H].Cl[H].NC(=N)c1ccc(N)cc1
Cl[H].Cl[H].NC(=N)c1ccc(N)cc1
InChI
1S/C7H9N3.2ClH/c8-6-3-1-5(2-4-6)7(9)10;;/h1-4H,8H2,(H3,9,10);2*1H
chave InChI
GHEHNICLPWTXJC-UHFFFAOYSA-N
Procurando produtos similares? Visita Guia de comparação de produtos
Nota de análise
Emmax: none
Outras notas
Competitive inhibitor of serine proteases; As a fluorescent probe for the active site of serine proteases
substituído por
Nº do produto
Descrição
Preços
Código de classe de armazenamento
11 - Combustible Solids
Classe de risco de água (WGK)
WGK 3
Ponto de fulgor (°F)
Not applicable
Ponto de fulgor (°C)
Not applicable
Equipamento de proteção individual
dust mask type N95 (US), Eyeshields, Gloves
Escolha uma das versões mais recentes:
Já possui este produto?
Encontre a documentação dos produtos que você adquiriu recentemente na biblioteca de documentos.
Os clientes também visualizaram
S A Evans et al.
The Journal of biological chemistry, 257(6), 3014-3017 (1982-03-25)
p-Aminobenzamidine is weakly fluorescent in neutral aqueous buffer, with excitation and emission maxima at 293 and 376 nm, respectively. Binding to trypsin results in a blue shift of the emission peak to 362 nm, and 50-fold fluorescence enhancement, while binding
Comparative studies on the inhibition of trypsin, plasmin, and thrombin by derivatives of benzylamine and benzamidine.
F Markwardt et al.
European journal of biochemistry, 6(4), 502-506 (1968-12-05)
STUDIES ON THE ACTIVE CENTER OF TRYPSIN. THE BINDING OF AMIDINES AND GUANIDINES AS MODELS OF THE SUBSTRATE SIDE CHAIN.
M MARES-GUIA et al.
The Journal of biological chemistry, 240, 1579-1585 (1965-04-01)
Nathan J Alves et al.
Biochemical and biophysical research communications, 457(3), 358-362 (2015-01-13)
The potent fibrinolytic enzyme, plasmin has numerous clinical applications for recannulizing vessels obstructed by thrombus. Despite its diminutive size, 91 kDa, success in the recombinant expression of this serine protease has been limited. For this reason, a truncated non-glycosylated plasmin
Nossa equipe de cientistas tem experiência em todas as áreas de pesquisa, incluindo Life Sciences, ciência de materiais, síntese química, cromatografia, química analítica e muitas outras.
Entre em contato com a assistência técnica