Síntese de peptídeos
Um peptídeo é composto por dois ou mais aminoácidos ligados por uma ligação amida, formando uma cadeia de aminoácidos com um comprimento típico de 2-70 aminoácidos. Os peptídeos diferem das proteínas por não precisarem passar pelo processo de enovelamento para terem atividade biológica. Peptídeos podem ocorrer de forma endógena como hormônios peptídicos, como a angiotensina, LHRH, encefalina, e como toxinas em plantas e animais. Os peptídeos são de grande interesse como compostos-guia para a descoberta de medicamentos e também podendo ser eles próprios medicamentos. Eles também têm aplicação em vacinas, biomateriais, sondas histológicas e são usados em grandes quantidades como antígenos para a geração de anticorpos.
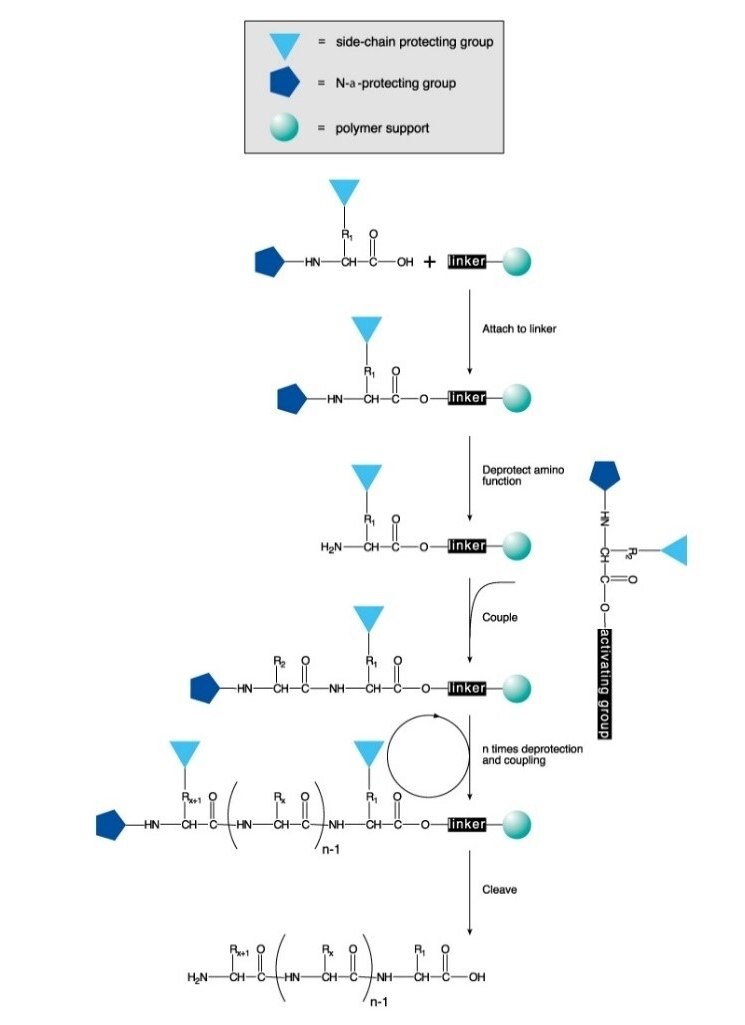
Os peptídeos são sintetizados quimicamente em solução ou em fase sólida. Esse processo envolve a formação direcionada e seletiva de uma ligação amida entre um aminoácido protegido por um grupo N e um aminoácido com um grupo amina livre e o ácido carboxílico protegido. Na síntese em fase sólida, o grupo que protege a carboxila é ligado a um polímero de suporte. Após a formação da ligação, o grupo protetor da amina do dipeptídeo é removido, e o próximo aminoácido com grupo N protegido é acoplado.
Artigos técnicos relacionados
- Fmoc resin cleavage and deprotection follows the difficult task of detaching the peptide from the resin support and removing all the side-chain protecting groups of the amino acid residues to yield the desired peptide.
- Novabiochem® offers a large number of coupling reagents for in situ activation. In situ activating reagents are easy to use, fast reacting – even with sterically hindered amino acids, and their use is generally free of side reactions.
- Review methods and resins for attaching amino acids and peptides, including Merrifield, trityl-based, and hydroxymethyl-functionalized resins. Resin-immobilized peptides can be used for various downstream applications.
- COMU is a non-explosive coupling agent suitable for solution phase & solid phase peptide synthesis. Its activity meets or exceeds that of HATU and its water-soluble by-product are easily removed.
- In principle, the seemingly simple formation of a peptide bond can be accomplished using all the procedures available in organic chemistry for the synthesis of carboxylic acid amides. However, due to the presence of various functional groups in natural and unnatural amino acids and particularly the requirement for full retention of chiral integrity, the coupling of amino acids and peptides under mild conditions can be challenging. A plethora of coupling reagents has been developed superseding each other in efficiency and suitability for specific applications (e.g., solid-phase peptide synthesis or fragment condensation).
- Ver todos (25)
Protocolos relacionados
- A guide to create solvent systems used for the thin-layer chromatography assay of Novabiochem products.
- Overcome challenges in synthesis and disulfide bond formation with protocols for Fmoc solid-phase peptide synthesis of peptides with cysteine and methionine.
- Amide Coupling in a Box
- Information on the Amide bond and the Catalytic Amide Bond Formation Protocol. Amidation of amines and alcohols. The amide bond, an important linkage in organic chemistry, is a key functional group in peptides, polymers, and many natural products and pharmaceuticals.
- We provide an overview of our available reagents, together with recommendations and details of their use for synthesis of peptides containing post-translationally modified amino acids.
- Ver todos (10)

Figura 2Grupos protetores de cadeias laterais para a síntese de peptídeos Boc em fase sólida (SPPS)
A síntese de peptídeos em fase sólida (SPPS) é o método mais comumente utilizado de síntese de peptídeos devido à sua eficiência, simplicidade, rapidez e facilidade de paralelização. A SPPS envolve a adição sequencial de resíduos de aminoácidos e de aminoácidos com cadeias laterais protegidas a um aminoácido ou peptídeo ligado a um suporte polimérico insolúvel (Figura 1).
A N-α-proteção é feita utilizando um grupo Boc suscetível a ácidos (Boc SPPS) ou um grupo Fmoc suscetível a bases (Fmoc SPPS). Após a remoção desse grupo protetor, o próximo aminoácido protegido é adicionado utilizando um reagente de acoplamento ou um derivado de aminoácido protegido pré-ativado. O aminoácido C-terminal é ancorado à resina por um ligante, cuja natureza determina as condições necessárias para a liberação do peptídeo do suporte após o alongamento da cadeia. Os grupos protetores de cadeias laterais costumam ser escolhidos de modo a serem clivados simultaneamente com o desprendimento do peptídeo da resina (Figura 2 e 3).

Figura 3.Grupos protetores para cadeias laterais para a síntese em fase sólida de peptídeos (SPPS) com Fmoc
A maioria dos peptídeos é preparada usando o método com Fmoc no qual a clivagem final e desproteção é realizada através do tratamento com ácido trifluoracético, diferentemente do método com Boc, que requer o uso de equipamento especializado com ácido fluorídrico (HF) anidro líquido, que é altamente corrosivo e tóxico.
Peptídeos de 50 aminoácidos podem ser preparados de forma rotineira, embora a síntese de proteínas com mais de 100 aminoácidos seja frequentemente relatada. Proteínas mais longas podem ser preparadas através da ligação química nativa de peptídeos totalmente desprotegidos em solução. Com essa metodologia, é possível sintetizar peptídeos naturais que são difíceis de serem expressos em bactérias, ou incorporar aminoácidos não naturais ou D-aminoácidos, e gerar peptídeos cíclicos, ramificados, marcados e com modificações pós-tradução.
A síntese de peptídeos em fase líquida que, em geral, utiliza proteção com Boc ou Z-amino, foi suplantada pela síntese de peptídeos em fase sólida, exceto para casos de processos existentes de síntese de peptídeos em larga escala para fins industriais.
Para continuar lendo, faça login ou crie uma conta.
Ainda não tem uma conta?