Descrizione generale
L′enzima collagenasi derivato da Clostridium histolyticum possiede un dominio di legame del collagene e domini simili alla malattia policistica del rene (PDK-like). Possiede anche un sito di legame Ca2+ per legare il calcio, essenziale per la sua funzionalità. L′uso della collagenasi è rivolto al trattamento della contrattura di Dupuytren, un disturbo del tessuto connettivo.′
Applicazioni
La collagenasi da
Clostridium histolyticum è stata usata per la digestione di:
- campioni di pancreas per l′isolamento delle isole
- campioni di arterie polmonari per l′isolamento di cellule muscolari lisce vascolari del polmone (PVSMC)
- campioni di cartilagine per l′isolamento di condrociti
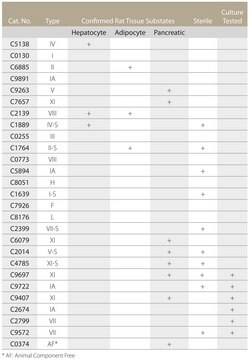
Questo prodotto è adatto per la disgregazione di tessuti tumorali umani, renali murini, cerebrali adulti e fetali, polmonari e di molti tipi di tessuti epiteliali. Si è dimostrato efficace anche in studi di perfusione epatica e renale, nella digestione del pancreas, nell′isolamento di cellule epatiche non parenchimali di ratto e nella preparazione di epatociti. La collagenasi è stata usata anche nella preparazione di tessuto arterioso per lo studio dei prodotti finali della glicolisazione avanzata. L′enzima è stato testato per l′isolamento di epatociti a una concentrazione di circa 1 mg/mL. Per la digestione si usano tipicamente concentrazioni comprese fra 0,1 e 5 mg/mL.
Azioni biochim/fisiol
Il prodotto a base di collagenasi è una miscela di enzimi secreti da C. histolyticum e i diversi prodotti si differenziano in base ai rispettivi rapporti tra i 10-18 componenti presenti negli enzimi secreti. I componenti principali sono due collagenasi, la clostripaina e una proteasi neutra. L′azione sinergica di questi enzimi degrada il collagene e altro materiale intracellulare. Per un′efficace liberazione delle cellule dal tessuto è necessaria l′azione di entrambe le collagenasi e della proteasi neutra. Diversi tipi di collagene costituiscono i substrati naturali della collagenasi.
La collagenasi è attivata da quattro grammi atomo di calcio per mole di enzima. È inibita da etilen-glicol-bis(beta-amminoetil etere) - acido N, N, N′,N′-tetraacetico, beta-mercaptoetanolo, glutatione, acido tioglicolico e 8-idrossichinolina.
Avvertenza
Questo prodotto come fornito è stabile per un anno a -20 °C. Non c′è perdita in FALGPA o nell′attività della proteasi in 30 giorni a 37 °C, 50 °C e -20 °C. Soluzioni di collagenasi grezza sono stabili se congelate rapidamente in aliquote (a 10 mg/mL) e mantenute congelate a -20 °C. Ulteriori cicli di congelamento-scongelamento danneggerebbero la soluzione. Il prodotto tenuto in ghiaccio conserva il 100% di attività per 7 ore.
Definizione di unità
Una unità di digestione del collagene (CDU) libera peptidi da collagene proveniente da tendine d′Achille bovino equivalente in colore ninidrina a 1,0 μmole di leucina in 5 ore a pH 7,4 a 37 °C in presenza di ioni calcio. Una unità di idrolisi FALGPA idrolizza 1,0 μmole di furilacriloil-Leu-Gly-Pro-Ala per minuto a 25 °C. Una unità di proteasi neutra idrolizza caseina e produce colore equivalente a 1,0 μmole di tirosina per 5 ore a pH 7,5 a 37 °C. Una unità di clostripaina idrolizza 1,0 μmole of BAEE per minuto a pH 7,6 a 25 °C in presenza di DTT.
Nota sulla preparazione
Questo prodotto viene preparato a partire dalla collagenasi di tipo XI (C7657) da Clostridium histolyticum. Contiene anche clostripaina, una proteasi neutra non specifica e attività triptiche. Solitamente le soluzioni si preparano a concentrazioni di 1-2 mg/mL in tampone TESCA, con 50 mM TES, 0,36 mM calcio cloruro, pH 7,4 a 37 °C.